第五节 致突变试验检测方法
熟悉致突变试验检测方法。
要对有潜在危害的大量化学物(包括药物)作出预报,就需要有快速、经济、灵敏、特异的初筛方法。自20世纪70年代开始,美、日、英、法、加拿大等国家相继建立了一系列快速过筛致癌物检测方法,至20世纪70年代末关于化学致突变物的检定和其特征确定短期筛选方法的发展,评价和应用已趋完善。据统计,突变作用的检测方法迄今已达100余种,但目前常用的检测方法只有8种:
⑴ 鼠伤寒沙门氏菌回复突变试验
⑵ 大肠杆菌回复突变试验
⑶ 哺乳动物体外细胞遗传试验
⑷ 微核试验
⑸ 哺乳动物体内骨细胞遗传试验
⑹ 哺乳动物体外细胞基因突变试验
⑺ 果蝇隐性伴性致死试验
⑻ 啮动物显性致死试验
目前检侧方法虽多,但其检测终点都反应在基因突变或染色体畸变上,从检测方法来分类大体上可分为下述三类:基因突变试验,染色体畸变试验和DNA损伤和修复试验。
一、基因突变试验
目前,一般认为癌的发生是由于DNA受损,导致体细胞发生突变的结果。药物致突变作用与致癌作用之间的关系可能通过两个途径:一是控制细胞分化基因产生突变,使细胞分化和生化特性的改变使其具有恶性细胞的特点;另一种可能是作用于转型特异性基因,使肿瘤基因得以诱导活化或表现。由此可见,突变可能是癌变过程的第一阶段,从而可能利用检查是否具有致突变作用来预测药物是否具有致痛作用。
基因突变试验可以用微生物、昆虫、哺乳动物细胞(包括人体细胞)和整体动物等为指示生物,以基因突变为观察终点。
1.鼠伤寒沙门氏菌回复突变试脸
鼠伤寒沙门氏菌营养缺陷型回复突变实验通常简称Ames试验,它是1975年由Ames本人完整地提出的用微生物检测致突变物的方法,是目前检测基因突变最常用方法之一。我国新药审批办法规定为致突变试验的首选试验。
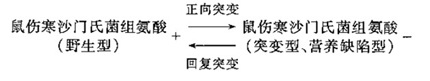
本试验是一种利用微生物来观察受试物可能引起基因突变的方法。某种可能引起致突变的受试物与微生物接触,则可引起细胞基因的突变,就会导致这种微生物在形态和生理上的相应改变,造成菌落形态、颜色和合成某种氨基酸功能的改变。这种发生了突变的微生物称突变型,原来的微生物称野生型,利用这种差别就可将未发生突变的野生型微生物同突变型微生物区别开来。如果一种受试物可使野生型微生物发生突变成为突变型,或者使突变型发生回复突变成为野生型,都有助于确定该种受试物是否具有致突变性的毒性作用。
可用来作为诱变指示物的微生物有噬菌体、细菌和真菌等。它们具有繁殖快、个体数量多以及容易观察检出等特点,而且方法较为敏感、检出率较高、试验时间短、费用也较低。但这些微生物是单细胞生物,与哺乳动物及人类有较大的差别,例如核结构不同,DNA裸露而且数量少,分子小,对化学诱变原不能进行代谢活化或降解以及缺乏免疫系统等。另外,有些受试物,在体外并不直接具有致突变性;而在哺乳动物体丙形成的代谢物却具有致突变作用。如果把这种受试物在平皿上与微生物直接接触,就不引起微生物的突变,其结果就会得出“假阴性”的结论。相反,某些在体外试验中可引起微生物发生突变作用的受试物,在哺乳动物体内经代谢后可失去其原有的致突变性,以致出现“假阳性”的结果。因此,这些都是利用微生物在体外进行致突变试验的不足之处,一般可用做初步筛检。
(1)原理 Ames试验法是利用组氨酸缺陷型的鼠伤寒沙门氏菌突变株为侧试指示菌,观察其在受试物作用下回复突变为野生型的一种测试方法。组氨酸缺陷型的鼠伤寒沙门氏菌在缺乏组氨酸的培养基上不能生长。但在加有致突变原的培养基上培养,则可使突变型产生回复突变成为野生型,即恢复合成组氨酸的能力,于是就能在缺乏组氨酸的培养基上生长为菌落,通过计数菌落出现的数目就可以估算受试物诱变性的强弱。
检测系统中还包括大鼠的肝微粒体酶(S9)体外代谢活化系统,使受试物在体外受到与活体内类似的氧化活化作用,故可测出间接诱变原。
(2)菌株:我国《新药审批办法》中规定使用TA97、TA98、TA100、TA102四种菌株,经检定符合要求,-80℃或液氮冻存备用。
(3)剂量:决定受试物最高剂量的标准是药物对细菌的毒性和溶解度。西药一般最大剂量可达5mg/ml,中药可超过5mg/ml,最低剂量一般1μg/ml,或0.1μg/ml,受试物至少应有五种不同剂量。
(4)对照组:用溶媒作阴性对照,用已知突变原作阳性对照。阳性诱变剂的选择应尽量优先选用对人无致癌性或尚未证实其致癌性的物质,以减少对人和环境可能带来的影响。对需使用间接诱变物作对照时,应注意,同时平行设加与不加S9代谢物的对照,以证实其为间接诱变物而非直接诱变物。同时又要考虑使用的阳性诱变剂在一般实验室易于获得。作为阳性对照或诊断阳性化合物,最好列出该结果的正式发表文章处,以便查阅和参考。
(5) 代谢活化:应用诱导剂处理后的哺乳动物肝脏微粒体酶(S9)进行体外代谢活化试验,即在加S9混合物和不加S9混合物平行的条件下测试。
大鼠肝脏酶的诱导及S9部分的制备:一般采用多氨联苯混合物(Aroclor1245)诱导处理后的大鼠匀浆(S9)。选用200g左右的雌性大鼠,杀死前5天每鼠每天腹腔注射Aroclor1254(溶于玉米油中,浓度为200mg/ml,剂量为500mg/kg。杀死前12小时开始禁食。诱导处理后第5天用击昏去头法处死大鼠,取出肝脏。将肝脏(每只大鼠肝重约10-15g)置于0.15M氯化钾(大致1ml/g肝湿重)的烧杯中。称重后再将肝脏移至含3倍肝重体积的0.15M氯化钾溶液(3mljg肝湿重)的烧杯中,用消毒剪剪碎肝脏,在匀浆器中制成匀浆。以1000r/min转速将匀浆离心10分钟,所获上清液就是S9部分。最后将S9分装于2ml塑料安置-80℃冰箱或液氮存放,一般保存使用期为一年。若发现S9活力明显减弱一,则应更换新制成品。上述操作都应用冷无菌溶液和玻璃器皿在0-4℃温度下进行。大约每250mg湿肝可制得lml含有微粒体的S9部分。各次制备的S9中蛋白含量相当恒定(大约40mg/rnl),新鲜的S9部分分装后速冻,于-80℃保存。实验当天配制成S9混合液,使用前可在冰中放置几小时。
除了Aroclor 1254外,还可用苯巴比妥,3-甲基胆蒽等诱导。有人比较了上述三种诱导剂及未经诱导的大鼠肝S9对于两种多环烃(3,4-苯并花和3-甲基胆蒽)以及一种芳香胺致癌物2-乙酞基的活化作用。结果表明,对于这三种试验化合物,经诱导大鼠比未经诱导者效果好,三种诱导方法中以Aroclor诱导后制备的S9检出效果最好。
一种特定的化合物要达到最适的致突变作用,平板中所需的S9的量是关键性的,过多和过少的S9,都会急剧地降低敏感性。有人通过实验发现Aroclor诱导的大鼠,每一平板加人20 -50μl S9(每毫升S9混合液有0 . 04 - 0 .1m1 S9)是通常筛选的适宜用量。
(6)平板试验法:顶层琼脂0. 6 % Difco agar, 0. 5 % NaCl)采用高压蒸汽消毒,置于100ml瓶中室温保存。应用前在蒸汽浴中加热融化,在融化的琼脂中加人0.5mML-盐酸组氨酸(L-histi-dine HCL),在0.5rnM生物素,使之充分混合。顶层琼脂中加人微量组氨酸及过量生物素,这对细菌在琼脂上均等的,一定限度地生长发育是必要的。
在45℃融溶状的2m1顶层用琼脂中,依次加人培养过夜的测试菌株营养肉温培养物0.1m1,测试样品0.1ml或少于0.1m1和S9混合液0.5mI(现需要加人),用手充分混合振荡后倾人萄葡糖琼脂底层培养基平板上(葡萄糖琼脂底层培养基为含琼脂0.5%,葡萄糖2%的Vogel-Bonner培养基)。稍微倾斜转动平板使顶层琼脂均匀,全面地扩散开,然后水平放置任其固化,上述操作应在20秒钟内完成,琼脂凝固后将平板放人 37℃的培养箱,2天后计算测试平板和对照平板的菌落数,如菌落太小,可继续培养延长到72小时观察结果。
(7)结果判定:受试物所诱发的回复突变菌落数(X/SD)增加,超过自发对照的2倍或以上,呈现可重复的并有统计学意义增加,符合上述一条即可判为阳性。
这是所指菌落数为自发对照的2倍,更确切地说是指测试组与对照组的菌落平均数比较,前者是后者的2倍或以上,即超过自发对照(包括溶剂对照)自发回变菌落1倍,不要理解为高于对照2倍。上述标准不是判断诱发剂与非诱发剂的准确界限,通常情况卞,若被检物呈阳性变化,只要剂量设计周密合理,一般还表现为呈剂量一效应关系。当不能获得线性剂量效应曲线或仅能获得某一剂量点的阳性结果时,实验结果的可重复性是很重要的,否则应检查试验系统中是否存在其它影响因素,以排出可能的假阳性结果。当然,试验本身也存在一定比例的假阴性结果,这就不是将Ames试验用于一般筛选目的所能解决的问题。对新.药的检测,只根据其测试结果可以判断。至于所得结果有否可能存在“假阴性”或“假阳性”结果,这只有留待做更多方面的深人研究后才能知道。
全世界用Ames法已检测了上万种化合物(包括药物)的结果。例如,呋喃糠酰胺在日本广泛运用作食品添加剂近10年。投人市场前曾两次用动物进行致癌试验,结果为阴性。经Ames试验侧试后,发现它是一种强致突变剂,再进行动物试验,结果在小鼠身上获得阳性。因此,被禁止使用。所以目前公认Arnes试验可作为可靠的筛选可能有突变作用的化学药物。
Ames试验测试时间短,3天内即可完成。而且试验费用低廉,目前使用范围也在日益扩大,除了检定化学(药物的突变作用外),而且还可以分析各成分的突变源作用,能从已定的诱变剂中找出非突变的衍生物,以及鉴定是否由于少量杂质引起的突变,并且也用粪尿成分的突变测定和检查食品、药物、糖精、香烟、添加剂等有无致癌作用。因此,Ames试验值得大大推广应用。
上而已述,Ames试验有许多优点,是诱变作用检测的首选方法之一。但它也有些不足之处在于有些物质如石棉和某些金属等不能检出,另外可出现10 %以上的假阴性与假阳性结果。
2. 哺乳动物培养细胞基因突变试验
哺乳动物体外培养细胞的基因正向突变试验常用的测试系统有小鼠淋巴瘤L5178Y细胞,中国仓鼠肺V79细胞和卵巢CHO细胞的兰个基因位点的突,即次黄喋岭、酸核糖转移酶(HGPRT)胸苷激酶(TK)及 Na+及Na + /K + ATP酶(OUA)位点,HGPRT和Na+/K + ATP酶位点突变可用于上述三种细胞,OUA位点突变仅适用于CHO细胞。HGPRT和TK可分别使6-硫代鸟嘌呤(6-TG)转移上磷酸核糖及使5-溴脱氧苷磷酰化,它们的代谢产物可掺人DNA引起细胞死亡。因此,正常细胞在含有这些碱基类似物的培养基中不能生长,在致突变物作用下比两个位点发生突变的细胞对这些碱基类似物具有抗药性,可以增殖成为克隆(细胞集落)。Na + /K + ATP酶是细胞膜的Na + /K +泵,鸟本苷可抑制此酶活性引起细胞死亡,当致突变物引起该位点突变后,Na + /K + ATP酶对鸟本苷的亲和力下降,而酶活性不变,故对培养基中的鸟本苷产生抗药性,并可增殖为克隆。
以V79细胞的HGPRT位点突变试验为例,以对数生长期的V79细胞105接种至培养皿,细胞接种后4-6小时,加人受试物并同时做阴性(溶剂)对照和阳性对照,4小时后更换无受试物的培养液,生长培养7--9天(表达期)。突变的基因需一定的时间才能表达,此时间称为表达期,如突变细胞未得到足够的表达时间,细胞内残存的HGPRT仍有活性,使已突变的细胞被选择培养基中的6-TG杀死,呈现假阴性。表达期后将细胞接种于含6-TG的选择培养基内,培养7天,选择完毕,固定,染色并计数克隆数。同时将细胞接种于非选择培养基内测定克隆形成率。

代谢活化系统可用S9混合液成大鼠肝原代培养细胞等。当试验组突变率高于自发突变率的1.5倍以上,并有剂量-反应关系时,可信为受试物具有致突变性。
整个试验可分为以下几步进行:
⑴细胞的准备;
⑵细胞与检品的接触;
⑶细胞毒性测定和表现型的表达;
⑷突变体的选择和细胞克服形成率的测定;
⑸资料分析。
由于正向突变试验是用细胞培养方法进行的。因此,它比动物体内研究药物致癌性相比还有以下优点:
①相对一致的细胞,培养在规定的合适的条件下,便于控制实验条件,不受动物体内营养,生理和免疫状态的影响,因而可以进行定量研究,实验重复性也好。
②能传代,保存,便于进行形态学和超微结构的观察及细胞化学,生物化学的分析。
③实验周期短,转化率高,每个平皿可培养出现几个或凡十个转化灶。
④经济,每一培养皿可相当一只实验动物。较体内动物试验所花的代价少。因此,目前用于常规药品的筛选。
二、哺乳动物培养细胞染色体畸变试验
染色体具有一定的形态和特殊的功能,是细胞内遗传物质DNA的载体,DNA分子的损伤、突变、必然影响到染色体组成成分,结构及功能的改变。因此,染色体的损害是测定化学致突变剂的重要一环。
染色体的数目因机体的种类而异,人有23对染色休,其中22对常染色体,1对性染色体。
由于生殖细胞和体细胞都可发生染色体畸变。因此,染色体畸变试验可分别在这两种细胞中进行,一般以骨髓或外周血细胞代表休细胞,睾丸精原细胞代表生殖细胞。在正常情况下,生物细胞染色体的数量,大小和形状是相对恒定的。如果在化学药物作用下,染色体数量或形态结构发生改变,即表现为染色体畸变。如服用苯妥英钠病人的淋巴细胞多倍体比率增高。多年服用乙内酰脲及巴比妥钠的妇女及小孩外周淋巴细胞染色体结构和数量的畸变。又如氯磺丙脉能诱发糖尿病人染色体畸变和染色互换,不少抗肿瘤药物均能诱发人类染色体畸变。
整体动物染色体畸变分析常用大鼠、小鼠或中国地鼠的骨髓细胞,肝细胞或精原细胞作分裂中期染色体分析。但由于整体动物试验操作繁琐,试验时间长,工作量较大,又不够灵敏,所以目前多使用包括人在内的哺乳类细胞株的体外试验代替整体动物试验。其优点是取材于哺乳动物或人体,在一定程度上能反映哺乳动物的实际情况,并能对结果进行定量的统计学处理,能在较短的时间内得出结果。缺点是傲验离开整体动物在试管内进行,一般较易诱发突变。
药物致癌可能通过损伤体细胞的遗传结构DNA或改变信息的实现过程而引起人类肿瘤的发生。已发现很多染色体断裂剂(clastogen)是致癌剂,虽然它们之间并不完全一致,但有密切联系。国际环境诱变剂和致癌剂防护委员会(ICPEMC,1983)认为0.6%的新生儿有染色体畸变,50%的自然流产有染色体畸变。分析动物骨髓细胞染色体畸变这个终点可推测人的体细胞的损害,从而预测致癌可能性。染色体畸变分析是一种简便、经济、利于推广的细胞遗传学研究方法,是探讨药物对人健康危害的一个手段。
1.染色体畸变试验
⑴ 剂量:至少应用三种不同剂量组,高剂量以50%细胞生长抑制浓度为基准。
⑵ 对照组:常用溶媒作阴性对照,已知染色体断裂剂作阳性对照。
⑶ 外周血淋巴细胞和培养。
①采血:用无菌于针筒或针筒用肝素湿润过,从静脉采血2-3m1,注人每毫升血含有肝素抗凝剂0.2ml(500/ml)的无菌小瓶内,轻轻震荡。
②培养:将无菌新鲜血0.4m1加人含5m1培养液(为克服体外实验缺乏代谢活化酶的缺点,在细胞培养基中需加人肝脏微粒体酶进行活化,以提高阳性检出率)的无菌培养瓶中,轻轻摇匀。将培养瓶放在37℃水浴或培养箱中培养72小时。
③受试物与培养细胞接触的时间:受试物(药物)与培养细胞接触后应用适当的时间,最好包括整个细胞周期,通常在受试物处理后24小时和48小时终止培养。
④阻止细胞分裂:为得到更多的分裂中期细胞,在370C温度下培养终止前4个半小时每瓶加人秋水仙素使终浓度为0.2g/ml。
(4)培养细胞的处理:
①从温箱中取出培养瓶,可见瓶底有一层培养物,小心吸取上清液,留下约1ml左右的沉淀物,加人低渗液0.075M的KCI溶液,或新鲜蒸馏水8m1(低渗前,先将低渗液于37℃温箱中预温)。用吸管冲打之后,移于离心管中在37℃温箱中静止20分钟。其目的是使红细胞溶血,白细胞膨胀,促进细胞内染色体分散。
②离心:1000rpm/min,离心5-8分钟。
③固定:吸去上清液,留下沉淀物,加人固定物(甲醇:冰醋酸=3:1)3-5m1(临用时配制,存放时间不宜超过1小时)。固定液应以吸管缓慢加人,并不时搅动细胞,在室温下放置15分钟,1000转/分,离心5-8分钟,弃去上清液,重复固定一次。
(5)标本制作:最后一次固定、离心后,留下底物,加人少童新鲜固定液,打匀、制成细胞悬浮液,滴1-2滴悬液在清洁无油脂的、已冰冻的干燥载玻片上,用嘴吹气,将玻片上的细胞悬液轻轻吹散,然后,用电吹风吹干或在酒精火焰上快速扇动玻片以加快晾干速度,但决不可让固定液点燃,否则会使细胞破裂。
(6)染色:一般常用Giemsa染色法。直接在Giemsa应用液中染色20分钟,取出用蒸馏水冲洗干静、晾干。
(7)镜检:先用低倍镜观察,寻找染色体分散度较好的图系,然后在高倍镜下观察染色体的变化。每种浓度至少观察100个中期分裂相细胞的染色体结构的异常(以染色体有无断裂、缺失、互换和裂隙等作为畸变指标)及多倍体的出现率。
(8)结果判定:根据出现畸变染色体的总数和染色体畸变的细胞数,计算畸变率。

受试物诱发的染色体畸变率较阴性对照有统计学意义的增加,并有剂量-反应关系时记为阳性,同时标明异常细胞出现的频率和种类。
注意事项:
(1)植物性血球凝集素(PHA)具有促使细胞转化的作用,系细胞培养液的重要成分。在培养液中必需加人此成分,其效价直接影响细胞培养成败。
(2)加人阻止细胞分裂的秋水仙素的时间要适当,否则影响收集细胞分裂中期的数目。
(3)培养细胞所需的温度在37℃±0℃之内,否则影响细胞生长和分裂。
(4)在用低渗处理细胞过程中,要注意用吸管吹气,若吹气不够时会影响细胞染色体的分散。
(5)固定时,特别是第一次固定,固定后,接着就用吸管吹气,避免形成集块影响制片。
(6)玻片要干净并冰冻过,当滴上细胞悬液时,要用嘴吹气,将悬液吹散,避免染色体重叠。
所有检出率增高可以反映染色体的畸变情况.细胞出现的频变与对照组相比有统计学意义时记为阳性,Giernsa染色中获得可疑阳性或弱阳性结果的药物,必须有叮吮橙荧光染色以进一步肯定或否定阳性结果,不易通过骨髓屏障的药物,可补充用哺乳动物肝细胞微核试验进一步研究。染色体畸变试验常用有三种:体外培养哺乳动物细胞染色体畸变试验,骨髓细胞染色体畸变试验及翠丸染色体畸变试验。
体外培养哺乳动物细胞染色体畸变试验可用人外周血淋巴细胞和培养的哺乳动物细胞(CHO细胞等)。人外周血淋巴细胞的染色体畸变试验是取肝素抗凝的人静脉血的含有植物凝集素(pHA,促细胞分裂剂)的PRMI1640培养液中培养。采血时淋巴细胞处于G0期,经PHA即植物凝集素刺激后,从开始培养到第一次有丝分裂约需44小时,故应在培养开始的头几小时及36-48小时分别染毒,以检侧受试物分别对GO、G1期和S、G2期的影响。受试物至少设三个剂量组,高浓度为细胞仍能进行有丝分裂的最大耐受浓度,低浓度可为高浓度的1/10,同时设阴性及阳性对照组。在染毒时可加大鼠肝S9混合液作代谢活化系统。细胞在染毒1-2小时后转人不含受试物的培养液中继续培养,收获时间最晚不超过开始培养50-52小时,收获前2小时给以秋水仙碱,使细胞停滞在分裂中期。然后经低渗、固定、制片和染色。油镜观察,每个样品至少分析100个中期相细胞,观察染色体结构和数目的变化,分别计算各组的畸变细胞率,与阴性对照比较,以X2检验其差异的显著性。
动物体内骨髓和睾丸染色体畸变试验多用初成年的啮齿类动物,常用小鼠或大鼠。急性试验为连续二天,每天染毒一次;亚急性试验为连续五夭,每天染毒一次。一般设三个剂量组,高剂量组用1/5-1/10的LD50或最大无作用剂量;低剂量组可用高剂量组的1/10,同时设阴性对照及阳性对照组。各组至少5只动物。于最后一次染毒后6小时处死动物。对骨髓染色体畸变试验,于处死前2小时腹腔注射秋水仙碱,处死取股骨骨髓,离心后再进行低渗、固定、制片及染色。每个动物观察50个中期分裂相细胞,计算每个动物的畸变细胞率,并与阴性对照比较,当t检验表明差别有显著性,且有剂量-反应关系时,则可认为受试物对该种动物的骨髓细胞有致突变作用。
对睾丸染色体畸变试验,于处死前5.5小时腹腔注射秋水仙碱,处死取睾丸,剪碎曲细精管,再经低渗、固定、软化、制片及染色。每个动物做两个皋丸观察50个中期相精原细胞的染色体畸变。统计分析同骨髓染色体分析。对此,也可进行皋丸初级精母细胞的染色体分析。
三、啮齿动物微核试验
啮齿动物微核试验是新药致突变试验(第一阶段)中惟一的一项体内试验,它是细胞培养染色体畸变试验的一项补充与验证。因此,微核试验虽然技术上并不复杂,但它在评价新药的致突变性时,与体外试验的细菌诱变和细胞染色体畸变试验组合成为一项较为科学合理而完整的评价系统。故对准确而可靠地做好微核试验有着重要意义。此外,微核的发生一方面与染色体无着丝点断片或环在细胞分裂,不能定向移动而留在细胞质中。另一方面,纺睡体功能或结构障碍也可能使整个染色体在细胞分裂末期被排人细胞质而形成。故微核试验对染色体完整性受损和染色体分离异常均可能检出。
啮齿动物微核试验:微核试验(The Micronucleus Test)是20世纪70年几代初由Matter和Schrnmid建立的用哺乳动物骨髓红细胞微核的出现率来检测化学物是否具有致突变活性的试验,故比较符合整体实际情况。但有时不够灵敏,不能反映生殖细胞的突变情况,作用于生殖系统的药物需进行显性致死试验。
原理:骨髓细胞经致突物作用,其染色体可发生畸变以至断裂。其断裂的碎片在分裂间期留在子代细胞内形成规则的一个或几个圆形或椭圆形结构的小块物质,由于它比普通细胞核要小,故称之微核。所以观察骨髓细胞中的微核率,有助于检验受试物是否具有致突变作用,但由于骨髓细胞中缺乏代谢活化酶系,对间接诱变物反应较差,具有一定的局限性。
啮齿动物微核试验:
(1)虽然骨髓和外周血液的各型有核细胞均可见到微核,但是在这类有核细胞中胞浆较少,正常的核叶及核的突出物极难以与微粒相鉴别,所以只有在无核的红细胞中才易辨认。在骨髓中无核的红细胞有嗜多染红细胞或称晚幼红细胞(呈灰蓝或浅蓝色)和成熟红细胞(呈粉红或桔红色)两种,正常情况下嗜多染红细胞占多数,由于毒性物质影响了骨髓红细胞尤其是嗜多染红细胞,可使其中的比例失衡,故在骨髓涂片中一般均在嗜多染红细胞中进行观察。同时由于骨髓细胞再生速度较快,微核增多确能反映接蚀致突变物后发生的变异。研究证明,微核检出率和染色体畸变率之间确有明显的相关性。
(2)动物《指导原则汇编》中推荐首选NIH小鼠,有的地区可能无此种小鼠,可改用国内常用的其它品系小鼠。
关于动物的选择,要求健康性成熟小鼠,试验一般首推NIH小鼠,体重未作具体要求,但为便于取骨髓制片,一般体重在20-24g较为适宜。
关于动物数与性别要求,实验要全部用雄性,每一剂量组至少6只;若雌雄兼用,则每组为10只,雌雄各半。
从动物中心领取或购买的小鼠,一般应在实验室饲养3-5天,使其适应新环境并注意观察并剔除不健康的动物。
(3)给药剂量;剂量设计是毒理学研究中的一个非常重要的间题。一般小鼠的微核试验至少采用3个剂量,最高剂量以1/2LD50为基准,否则应说明选择剂量的理由。要求最高剂量达到1/2LD50是为了尽可能发现药物本身可能具有的毒作用。另一方面,低剂量组的设计则应考虑药效学试验结果或人临床拟用剂量,即是说低剂量的设计就是有效剂量或临床拟用剂量。当最高与最低剂量一经确定后,中间剂量即可按一定比例设置。
新药剂量设计的另一原则与方法,就是完全参照其临床拟用剂量来设计,这种情形在实际工作中并不少见。至于小鼠微核试验的剂量设计,高剂量组也可考虑用临床剂量的100倍或以上,若存在某些理由或实际困难,应不低于临床拟用剂量30-50倍,否则难以说明试验结果的实际意义。
(4)给药途径与方法:小鼠微核试验给药途径应尽可能和临床拟用途径相同。但也有少量例外的情况,例如某些外用新药,如经皮肤给药,会存在给药剂量的准确性问题,通常可考虑采用肌内或皮下途径给药来代替。
关于给药频率,一般情况下均按剂量一次给药,若有恰当理由,也可采用诱导或多次给药方法。
(5) 对照组设置:必须设阴性(空白)、溶剂和阳性对照。
阳性对照在微核试验中是必不可少的,用已知的阳性药物事得肯定的阳性变化,可以表明试验所用动物的反应性及试验条件的可靠性,反之,则应视为试验的失败,应查明原因并再次试验,直到获得肯定的结果。
最常使用的阳性药物为环磷酞胺,只要剂量选择恰当,几种常用给药途径均能诱发微核率升高,且有剂量效应关系。
(6) 骨髓采样时间:通过预试,在12-72小时不同时间内,取5个作用点,找出合适采样时间处死动物取骨髓样本观察核微率情况。若给药后各时间点的核微率无显著变化,则通常可采用给药后24小时处死动物采集骨髓。
(7) 骨髓直接涂片法:
① 小鼠脱颈椎处死(大鼠断头处死)。将鼠固定,来苏冲洗,切开皮肤、肌肉,取出股骨二根(大鼠一根),用纱布擦净,纵形剪去股骨1/4-1/3,用大头针或针头挑出骨髓,放在已滴好一小滴小牛血清的载玻片上.(血清宜滴在载玻片的一端),另取一块边缘整齐的载玻片,在血清上轻轻按摩,让骨髓团块完全分散均匀,然后以45-50度角快速推片,在空气中晾干。
②固定:将涂片放人甲醇中固定5---10分钟,待干后进行染色或保存数月或至数年后再染色。
③染色:将涂片置于应用液中,染色10-30分钟(视室温而容,室温高染色时问可短些,室温低所需时间则长些)。取出染片用pH6-8磷酸盐缓冲液反复冲洗,或用自来水冲洗破片,再用蒸馏水冲洗,在空气中晾干或37℃恒温箱中烘干。
④封片:如长期保存时可将晾干或烘干的染片放人二甲苯5-10分钟,取出滴上一滴光学树脂胶,封上盖玻片,注意切勿有气泡。
另外还有离心法制作标本。
(8) 微核的观察与鉴别:典型的微核是单一的,呈圆形,边缘光滑整齐,嗜色性与核质一致,直径相当于红细胞直径的1/20-1/5-,偶有肾形,环形等,用Giemsa染色后,微核呈紫红色或兰紫色。
先用低倍镜、高倍镜粗检,以有核细胞形态完好作为判断制片优劣的标准,选择细胞分散均匀、细胞完整、染色好的区域,再换成油镜计数。每只动物至少观察计数1 000个嗜多染红细胞,观察其微核出现的频率及嗜多染红细胞中出现两个或更多个微核,仍按一个微核细胞计算。
镜检时,嗜多染红细胞和成熟红细胞。由于它们有着不同一般是可区别的。但是由于骨髓细胞始终处于幼稚到成熟不断发展的过程。红细胞的着色也是由蓝变红的,所以有时难以区别这两种红细胞,在这种情况下就不一定区分两种红细胞而计数红细胞中总的微核率即可。
(9)制片及镜检中的注意点:骨髓直接涂片法关键在于让细胞分散均匀,推片技术要求熟练,否则,细胞易成堆,影响观察,对于初学者每只鼠适当地多涂几片,以供挑选,如细胞分布很不均匀或细胞变形破碎就弃之不用。涂片染色后,先滴上几滴二甲苯,在显微镜下观察细胞分布着色情况,如着色太淡,可置人Giernsa应用液中重染。
镜检时有时会发现类似微核的人为异物,其主要来源于染料的颗粒和骨髓细胞破碎的颗粒,大小,染色可能与微核非常类似。这些颗粒往往数目较多,外形不规则,杂乱无章地分布于各类细胞上面,观察时应小心加以鉴别。
(10) 结果判定:正常情况下,骨髓嗜多染红细胞中微核的检出率小鼠为0.4%左右,大鼠为0.2%左右,如遇致突变物质,微核的检出率可显著增加,由于微核是染色体畸变断裂所造成的结果,所以微核检出率增高可以反映染色体的畸变情况,微核细胞出现的频率与对照组相比有统计学意义时记为阳性,Giexnsa染色中获得可疑阳性或弱阳性结果的药物,必须用吖啶橙荧光染色以进一步肯定或否定阳性结果,不易通过骨髓屏障的药物,可补充用哺乳动物肝细胞微核试验进一步研究。
近年来国内外学者对微核试验在方法学上进行了不少的探索和改进。上述的骨髓嗜多染红细胞微核测定法具有简便、经济、快速、可靠等优点,仍是当今各种微核测定法中的一种首选方法。然而,由于它取样于骨髓,不能对实验动物作多次取样实验,难以观察化学物质在体内产生致突变作用的强度和持续时间,所以有人提出外周血淋巴细胞微核测定法可能弥补骨髓嗜多染红细胞微核测定法的不足,但此法又具有敏感性低,判断微核准确性较差,取血量多,操作繁琐等缺点。1988年陈世明等建立了一种快速检测外周血嗜多染红细胞微核的新方法,即常规制备皿片,用0.1%叮咤橙染色,于荧光显微镜下观察,作者认为此法与骨髓嗜多染红细胞微核测定法相比,不仅具有类似的敏感性和可靠性,而且具有更快速(在制备标本方而快15倍,在镜检方而快3倍)。更简便,更经济,能在同一动物体内反复多次进行实验,以观察化学物质诱发微核作用高峰时间和作用持续时间的优点。其缺点是染色后标本不能永久保持,以及不能检测嗜多染红细胞与成熟红细胞的比值。随着研究的不断深入,这些研究方法和手段也将会更加完善。
四、啮齿类动物显性致死试验
原理:动物显性致死试验是观察哺乳动物生殖细胞染色体损伤的一种方法。生殖细胞在减数分裂期和受精期最易发生突变,突变后失去与异性生殖细胞结合的能力或者结合后会出现发育不正常的胚胎,以致造成总着床数减少或早期胚胎死亡及畸胎等现象。常用性成熟的雄性小鼠15只,孕鼠20只以上。
一般设三个剂量组,最高剂量约为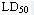 的1/10-1/3,一次或连续,每天染毒一次(灌胃或腹腔注射),同时设阴性和阳性对照组,于最后一次染毒后1-2天开始交配,每只雄鼠与2-3只雌鼠同笼5天。休息两天后另与2-3只未交配过的新雌鼠同笼5天。如此连续6-8周。每只雌鼠于同笼的第3天算起的第13-14只处死,检查子宫的着床数、早期死胎、晚期死胎和活胎数。计算各组的受孕率,着床数、活胎数、早期死胎数(以着床数计)。
的1/10-1/3,一次或连续,每天染毒一次(灌胃或腹腔注射),同时设阴性和阳性对照组,于最后一次染毒后1-2天开始交配,每只雄鼠与2-3只雌鼠同笼5天。休息两天后另与2-3只未交配过的新雌鼠同笼5天。如此连续6-8周。每只雌鼠于同笼的第3天算起的第13-14只处死,检查子宫的着床数、早期死胎、晚期死胎和活胎数。计算各组的受孕率,着床数、活胎数、早期死胎数(以着床数计)。
经适当的统计学分析,如平均活胎数显著减少,平均死胎数显著增加,有一个或多个死胎的母鼠数增加三项标准中有两项达到要求,即可判为阳性。分析各周交配的显性致死情况,可检出精子是处于哪个发育阶段受到遗传毒作用。染毒后头3周交配的结果表示对精子和精细胞的作用。第4-5周交配的结果表示对精细胞的作用,第6周及以后的结果表示对精原细胞和干细胞的作用。
此法在动物体内进行,不需要特殊设备,观察容易,结果明确,能反映遗传损伤的直接后果,是一种较为实用的方法。缺点是只在严重突变时,才能引起胚胎死亡。因此,不够灵敏,而且只限于观察生殖细胞。
五、 DNA损伤试验
姐妹染色单体交换试验(Sister-chromatid exchange, SCE)
SCE是染色体同源座位上DNA复制产物的相互交换,SCE可能与DNA的断裂和重接有关,提示DNA损伤。细胞在含5-溴脱氧尿苷(Brdu)的培养液中生长两周期,Brdu可取代胸腺嘧啶掺入DNA。在第一个细胞周期,染色体的两条单体各有一条DNA链掺人Brdu,此时两姐妹染色单体之间染色没有区别,但到了第二个周期的分裂中期,染色体的一条单体保留了原来不含Brdu的模板链,而另一条是以第一周期中掺人Brdu的新合成链为模板链。这样,两条姐妹染色单体内夹着深浅不同的染色体片段而被识别和计数。SCE试验可选入周围血淋巴细胞,培养的哺乳动物细胞(CHO等)。人周围血淋巴细胞的培养,染毒等过程同染色体畸变试验,在细胞培养2小时后,加入Brdu,然后过66-78小时加秋水仙碱,收获、低渗、固定、紫外线照、加吉姆萨染色,每个剂量至少观察50个中期细胞。在有SCE的染色体上计数在一个染色单体中染色深浅转变的数目,即为该染色体的SCE次数。计算各剂量组每个细胞平均SCE数及标准差,与对照组比较,用单侧t检验进行统计分析。当差别有显著性,并有剂量一反应关系时,可判结果为阳性。
SCE试验方法的优缺点:SCE是一种相当简易,加速和灵敏的检测诱变剂的方法。能很好地检出产生DNA加合物(adducts)的化合物,如烷化剂,它不仅能检出强的致癌性诱变物,也能检出像塘精那样弱的诱变剂和弱致癌剂。
但形成SCE的机理未明,SCE虽可作为DNA损伤的“信息”, 但只能反映损伤的很小一部分。如SCE试验对能诱导DNA双链断裂的博莱霉素相当不敏感,对需要反复慢性接触的致癌物也不敏感。当化合物低达靶组织前,活化不充分或物质有反应性都可导致假阴性。因此,SCE阳性反应较阴性反应具有更大意义。阳性结果一般表明化合物是诱变性的致癌剂(因有少数假阳性)。
要对有潜在危害的大量化学物(包括药物)作出预报,就需要有快速、经济、灵敏、特异的初筛方法。自20世纪70年代开始,美、日、英、法、加拿大等国家相继建立了一系列快速过筛致癌物检测方法,至20世纪70年代末关于化学致突变物的检定和其特征确定短期筛选方法的发展,评价和应用已趋完善。据统计,突变作用的检测方法迄今已达100余种,但目前常用的检测方法只有8种:
⑴ 鼠伤寒沙门氏菌回复突变试验
⑵ 大肠杆菌回复突变试验
⑶ 哺乳动物体外细胞遗传试验
⑷ 微核试验
⑸ 哺乳动物体内骨细胞遗传试验
⑹ 哺乳动物体外细胞基因突变试验
⑺ 果蝇隐性伴性致死试验
⑻ 啮动物显性致死试验
目前检侧方法虽多,但其检测终点都反应在基因突变或染色体畸变上,从检测方法来分类大体上可分为下述三类:基因突变试验,染色体畸变试验和DNA损伤和修复试验。
一、基因突变试验
目前,一般认为癌的发生是由于DNA受损,导致体细胞发生突变的结果。药物致突变作用与致癌作用之间的关系可能通过两个途径:一是控制细胞分化基因产生突变,使细胞分化和生化特性的改变使其具有恶性细胞的特点;另一种可能是作用于转型特异性基因,使肿瘤基因得以诱导活化或表现。由此可见,突变可能是癌变过程的第一阶段,从而可能利用检查是否具有致突变作用来预测药物是否具有致痛作用。
基因突变试验可以用微生物、昆虫、哺乳动物细胞(包括人体细胞)和整体动物等为指示生物,以基因突变为观察终点。
1.鼠伤寒沙门氏菌回复突变试脸
鼠伤寒沙门氏菌营养缺陷型回复突变实验通常简称Ames试验,它是1975年由Ames本人完整地提出的用微生物检测致突变物的方法,是目前检测基因突变最常用方法之一。我国新药审批办法规定为致突变试验的首选试验。
本试验是一种利用微生物来观察受试物可能引起基因突变的方法。某种可能引起致突变的受试物与微生物接触,则可引起细胞基因的突变,就会导致这种微生物在形态和生理上的相应改变,造成菌落形态、颜色和合成某种氨基酸功能的改变。这种发生了突变的微生物称突变型,原来的微生物称野生型,利用这种差别就可将未发生突变的野生型微生物同突变型微生物区别开来。如果一种受试物可使野生型微生物发生突变成为突变型,或者使突变型发生回复突变成为野生型,都有助于确定该种受试物是否具有致突变性的毒性作用。
可用来作为诱变指示物的微生物有噬菌体、细菌和真菌等。它们具有繁殖快、个体数量多以及容易观察检出等特点,而且方法较为敏感、检出率较高、试验时间短、费用也较低。但这些微生物是单细胞生物,与哺乳动物及人类有较大的差别,例如核结构不同,DNA裸露而且数量少,分子小,对化学诱变原不能进行代谢活化或降解以及缺乏免疫系统等。另外,有些受试物,在体外并不直接具有致突变性;而在哺乳动物体丙形成的代谢物却具有致突变作用。如果把这种受试物在平皿上与微生物直接接触,就不引起微生物的突变,其结果就会得出“假阴性”的结论。相反,某些在体外试验中可引起微生物发生突变作用的受试物,在哺乳动物体内经代谢后可失去其原有的致突变性,以致出现“假阳性”的结果。因此,这些都是利用微生物在体外进行致突变试验的不足之处,一般可用做初步筛检。
(1)原理 Ames试验法是利用组氨酸缺陷型的鼠伤寒沙门氏菌突变株为侧试指示菌,观察其在受试物作用下回复突变为野生型的一种测试方法。组氨酸缺陷型的鼠伤寒沙门氏菌在缺乏组氨酸的培养基上不能生长。但在加有致突变原的培养基上培养,则可使突变型产生回复突变成为野生型,即恢复合成组氨酸的能力,于是就能在缺乏组氨酸的培养基上生长为菌落,通过计数菌落出现的数目就可以估算受试物诱变性的强弱。

检测系统中还包括大鼠的肝微粒体酶(S9)体外代谢活化系统,使受试物在体外受到与活体内类似的氧化活化作用,故可测出间接诱变原。
(2)菌株:我国《新药审批办法》中规定使用TA97、TA98、TA100、TA102四种菌株,经检定符合要求,-80℃或液氮冻存备用。
(3)剂量:决定受试物最高剂量的标准是药物对细菌的毒性和溶解度。西药一般最大剂量可达5mg/ml,中药可超过5mg/ml,最低剂量一般1μg/ml,或0.1μg/ml,受试物至少应有五种不同剂量。
(4)对照组:用溶媒作阴性对照,用已知突变原作阳性对照。阳性诱变剂的选择应尽量优先选用对人无致癌性或尚未证实其致癌性的物质,以减少对人和环境可能带来的影响。对需使用间接诱变物作对照时,应注意,同时平行设加与不加S9代谢物的对照,以证实其为间接诱变物而非直接诱变物。同时又要考虑使用的阳性诱变剂在一般实验室易于获得。作为阳性对照或诊断阳性化合物,最好列出该结果的正式发表文章处,以便查阅和参考。
(5) 代谢活化:应用诱导剂处理后的哺乳动物肝脏微粒体酶(S9)进行体外代谢活化试验,即在加S9混合物和不加S9混合物平行的条件下测试。
大鼠肝脏酶的诱导及S9部分的制备:一般采用多氨联苯混合物(Aroclor1245)诱导处理后的大鼠匀浆(S9)。选用200g左右的雌性大鼠,杀死前5天每鼠每天腹腔注射Aroclor1254(溶于玉米油中,浓度为200mg/ml,剂量为500mg/kg。杀死前12小时开始禁食。诱导处理后第5天用击昏去头法处死大鼠,取出肝脏。将肝脏(每只大鼠肝重约10-15g)置于0.15M氯化钾(大致1ml/g肝湿重)的烧杯中。称重后再将肝脏移至含3倍肝重体积的0.15M氯化钾溶液(3mljg肝湿重)的烧杯中,用消毒剪剪碎肝脏,在匀浆器中制成匀浆。以1000r/min转速将匀浆离心10分钟,所获上清液就是S9部分。最后将S9分装于2ml塑料安置-80℃冰箱或液氮存放,一般保存使用期为一年。若发现S9活力明显减弱一,则应更换新制成品。上述操作都应用冷无菌溶液和玻璃器皿在0-4℃温度下进行。大约每250mg湿肝可制得lml含有微粒体的S9部分。各次制备的S9中蛋白含量相当恒定(大约40mg/rnl),新鲜的S9部分分装后速冻,于-80℃保存。实验当天配制成S9混合液,使用前可在冰中放置几小时。
除了Aroclor 1254外,还可用苯巴比妥,3-甲基胆蒽等诱导。有人比较了上述三种诱导剂及未经诱导的大鼠肝S9对于两种多环烃(3,4-苯并花和3-甲基胆蒽)以及一种芳香胺致癌物2-乙酞基的活化作用。结果表明,对于这三种试验化合物,经诱导大鼠比未经诱导者效果好,三种诱导方法中以Aroclor诱导后制备的S9检出效果最好。
一种特定的化合物要达到最适的致突变作用,平板中所需的S9的量是关键性的,过多和过少的S9,都会急剧地降低敏感性。有人通过实验发现Aroclor诱导的大鼠,每一平板加人20 -50μl S9(每毫升S9混合液有0 . 04 - 0 .1m1 S9)是通常筛选的适宜用量。
(6)平板试验法:顶层琼脂0. 6 % Difco agar, 0. 5 % NaCl)采用高压蒸汽消毒,置于100ml瓶中室温保存。应用前在蒸汽浴中加热融化,在融化的琼脂中加人0.5mML-盐酸组氨酸(L-histi-dine HCL),在0.5rnM生物素,使之充分混合。顶层琼脂中加人微量组氨酸及过量生物素,这对细菌在琼脂上均等的,一定限度地生长发育是必要的。
在45℃融溶状的2m1顶层用琼脂中,依次加人培养过夜的测试菌株营养肉温培养物0.1m1,测试样品0.1ml或少于0.1m1和S9混合液0.5mI(现需要加人),用手充分混合振荡后倾人萄葡糖琼脂底层培养基平板上(葡萄糖琼脂底层培养基为含琼脂0.5%,葡萄糖2%的Vogel-Bonner培养基)。稍微倾斜转动平板使顶层琼脂均匀,全面地扩散开,然后水平放置任其固化,上述操作应在20秒钟内完成,琼脂凝固后将平板放人 37℃的培养箱,2天后计算测试平板和对照平板的菌落数,如菌落太小,可继续培养延长到72小时观察结果。
(7)结果判定:受试物所诱发的回复突变菌落数(X/SD)增加,超过自发对照的2倍或以上,呈现可重复的并有统计学意义增加,符合上述一条即可判为阳性。
这是所指菌落数为自发对照的2倍,更确切地说是指测试组与对照组的菌落平均数比较,前者是后者的2倍或以上,即超过自发对照(包括溶剂对照)自发回变菌落1倍,不要理解为高于对照2倍。上述标准不是判断诱发剂与非诱发剂的准确界限,通常情况卞,若被检物呈阳性变化,只要剂量设计周密合理,一般还表现为呈剂量一效应关系。当不能获得线性剂量效应曲线或仅能获得某一剂量点的阳性结果时,实验结果的可重复性是很重要的,否则应检查试验系统中是否存在其它影响因素,以排出可能的假阳性结果。当然,试验本身也存在一定比例的假阴性结果,这就不是将Ames试验用于一般筛选目的所能解决的问题。对新.药的检测,只根据其测试结果可以判断。至于所得结果有否可能存在“假阴性”或“假阳性”结果,这只有留待做更多方面的深人研究后才能知道。
全世界用Ames法已检测了上万种化合物(包括药物)的结果。例如,呋喃糠酰胺在日本广泛运用作食品添加剂近10年。投人市场前曾两次用动物进行致癌试验,结果为阴性。经Ames试验侧试后,发现它是一种强致突变剂,再进行动物试验,结果在小鼠身上获得阳性。因此,被禁止使用。所以目前公认Arnes试验可作为可靠的筛选可能有突变作用的化学药物。
Ames试验测试时间短,3天内即可完成。而且试验费用低廉,目前使用范围也在日益扩大,除了检定化学(药物的突变作用外),而且还可以分析各成分的突变源作用,能从已定的诱变剂中找出非突变的衍生物,以及鉴定是否由于少量杂质引起的突变,并且也用粪尿成分的突变测定和检查食品、药物、糖精、香烟、添加剂等有无致癌作用。因此,Ames试验值得大大推广应用。
上而已述,Ames试验有许多优点,是诱变作用检测的首选方法之一。但它也有些不足之处在于有些物质如石棉和某些金属等不能检出,另外可出现10 %以上的假阴性与假阳性结果。
2. 哺乳动物培养细胞基因突变试验
哺乳动物体外培养细胞的基因正向突变试验常用的测试系统有小鼠淋巴瘤L5178Y细胞,中国仓鼠肺V79细胞和卵巢CHO细胞的兰个基因位点的突,即次黄喋岭、酸核糖转移酶(HGPRT)胸苷激酶(TK)及 Na+及Na + /K + ATP酶(OUA)位点,HGPRT和Na+/K + ATP酶位点突变可用于上述三种细胞,OUA位点突变仅适用于CHO细胞。HGPRT和TK可分别使6-硫代鸟嘌呤(6-TG)转移上磷酸核糖及使5-溴脱氧苷磷酰化,它们的代谢产物可掺人DNA引起细胞死亡。因此,正常细胞在含有这些碱基类似物的培养基中不能生长,在致突变物作用下比两个位点发生突变的细胞对这些碱基类似物具有抗药性,可以增殖成为克隆(细胞集落)。Na + /K + ATP酶是细胞膜的Na + /K +泵,鸟本苷可抑制此酶活性引起细胞死亡,当致突变物引起该位点突变后,Na + /K + ATP酶对鸟本苷的亲和力下降,而酶活性不变,故对培养基中的鸟本苷产生抗药性,并可增殖为克隆。
以V79细胞的HGPRT位点突变试验为例,以对数生长期的V79细胞105接种至培养皿,细胞接种后4-6小时,加人受试物并同时做阴性(溶剂)对照和阳性对照,4小时后更换无受试物的培养液,生长培养7--9天(表达期)。突变的基因需一定的时间才能表达,此时间称为表达期,如突变细胞未得到足够的表达时间,细胞内残存的HGPRT仍有活性,使已突变的细胞被选择培养基中的6-TG杀死,呈现假阴性。表达期后将细胞接种于含6-TG的选择培养基内,培养7天,选择完毕,固定,染色并计数克隆数。同时将细胞接种于非选择培养基内测定克隆形成率。

代谢活化系统可用S9混合液成大鼠肝原代培养细胞等。当试验组突变率高于自发突变率的1.5倍以上,并有剂量-反应关系时,可信为受试物具有致突变性。
整个试验可分为以下几步进行:
⑴细胞的准备;
⑵细胞与检品的接触;
⑶细胞毒性测定和表现型的表达;
⑷突变体的选择和细胞克服形成率的测定;
⑸资料分析。
由于正向突变试验是用细胞培养方法进行的。因此,它比动物体内研究药物致癌性相比还有以下优点:
①相对一致的细胞,培养在规定的合适的条件下,便于控制实验条件,不受动物体内营养,生理和免疫状态的影响,因而可以进行定量研究,实验重复性也好。
②能传代,保存,便于进行形态学和超微结构的观察及细胞化学,生物化学的分析。
③实验周期短,转化率高,每个平皿可培养出现几个或凡十个转化灶。
④经济,每一培养皿可相当一只实验动物。较体内动物试验所花的代价少。因此,目前用于常规药品的筛选。
二、哺乳动物培养细胞染色体畸变试验
染色体具有一定的形态和特殊的功能,是细胞内遗传物质DNA的载体,DNA分子的损伤、突变、必然影响到染色体组成成分,结构及功能的改变。因此,染色体的损害是测定化学致突变剂的重要一环。
染色体的数目因机体的种类而异,人有23对染色休,其中22对常染色体,1对性染色体。
由于生殖细胞和体细胞都可发生染色体畸变。因此,染色体畸变试验可分别在这两种细胞中进行,一般以骨髓或外周血细胞代表休细胞,睾丸精原细胞代表生殖细胞。在正常情况下,生物细胞染色体的数量,大小和形状是相对恒定的。如果在化学药物作用下,染色体数量或形态结构发生改变,即表现为染色体畸变。如服用苯妥英钠病人的淋巴细胞多倍体比率增高。多年服用乙内酰脲及巴比妥钠的妇女及小孩外周淋巴细胞染色体结构和数量的畸变。又如氯磺丙脉能诱发糖尿病人染色体畸变和染色互换,不少抗肿瘤药物均能诱发人类染色体畸变。
整体动物染色体畸变分析常用大鼠、小鼠或中国地鼠的骨髓细胞,肝细胞或精原细胞作分裂中期染色体分析。但由于整体动物试验操作繁琐,试验时间长,工作量较大,又不够灵敏,所以目前多使用包括人在内的哺乳类细胞株的体外试验代替整体动物试验。其优点是取材于哺乳动物或人体,在一定程度上能反映哺乳动物的实际情况,并能对结果进行定量的统计学处理,能在较短的时间内得出结果。缺点是傲验离开整体动物在试管内进行,一般较易诱发突变。
药物致癌可能通过损伤体细胞的遗传结构DNA或改变信息的实现过程而引起人类肿瘤的发生。已发现很多染色体断裂剂(clastogen)是致癌剂,虽然它们之间并不完全一致,但有密切联系。国际环境诱变剂和致癌剂防护委员会(ICPEMC,1983)认为0.6%的新生儿有染色体畸变,50%的自然流产有染色体畸变。分析动物骨髓细胞染色体畸变这个终点可推测人的体细胞的损害,从而预测致癌可能性。染色体畸变分析是一种简便、经济、利于推广的细胞遗传学研究方法,是探讨药物对人健康危害的一个手段。
1.染色体畸变试验
⑴ 剂量:至少应用三种不同剂量组,高剂量以50%细胞生长抑制浓度为基准。
⑵ 对照组:常用溶媒作阴性对照,已知染色体断裂剂作阳性对照。
⑶ 外周血淋巴细胞和培养。
①采血:用无菌于针筒或针筒用肝素湿润过,从静脉采血2-3m1,注人每毫升血含有肝素抗凝剂0.2ml(500/ml)的无菌小瓶内,轻轻震荡。
②培养:将无菌新鲜血0.4m1加人含5m1培养液(为克服体外实验缺乏代谢活化酶的缺点,在细胞培养基中需加人肝脏微粒体酶进行活化,以提高阳性检出率)的无菌培养瓶中,轻轻摇匀。将培养瓶放在37℃水浴或培养箱中培养72小时。
③受试物与培养细胞接触的时间:受试物(药物)与培养细胞接触后应用适当的时间,最好包括整个细胞周期,通常在受试物处理后24小时和48小时终止培养。
④阻止细胞分裂:为得到更多的分裂中期细胞,在370C温度下培养终止前4个半小时每瓶加人秋水仙素使终浓度为0.2g/ml。
(4)培养细胞的处理:
①从温箱中取出培养瓶,可见瓶底有一层培养物,小心吸取上清液,留下约1ml左右的沉淀物,加人低渗液0.075M的KCI溶液,或新鲜蒸馏水8m1(低渗前,先将低渗液于37℃温箱中预温)。用吸管冲打之后,移于离心管中在37℃温箱中静止20分钟。其目的是使红细胞溶血,白细胞膨胀,促进细胞内染色体分散。
②离心:1000rpm/min,离心5-8分钟。
③固定:吸去上清液,留下沉淀物,加人固定物(甲醇:冰醋酸=3:1)3-5m1(临用时配制,存放时间不宜超过1小时)。固定液应以吸管缓慢加人,并不时搅动细胞,在室温下放置15分钟,1000转/分,离心5-8分钟,弃去上清液,重复固定一次。
(5)标本制作:最后一次固定、离心后,留下底物,加人少童新鲜固定液,打匀、制成细胞悬浮液,滴1-2滴悬液在清洁无油脂的、已冰冻的干燥载玻片上,用嘴吹气,将玻片上的细胞悬液轻轻吹散,然后,用电吹风吹干或在酒精火焰上快速扇动玻片以加快晾干速度,但决不可让固定液点燃,否则会使细胞破裂。
(6)染色:一般常用Giemsa染色法。直接在Giemsa应用液中染色20分钟,取出用蒸馏水冲洗干静、晾干。
(7)镜检:先用低倍镜观察,寻找染色体分散度较好的图系,然后在高倍镜下观察染色体的变化。每种浓度至少观察100个中期分裂相细胞的染色体结构的异常(以染色体有无断裂、缺失、互换和裂隙等作为畸变指标)及多倍体的出现率。
(8)结果判定:根据出现畸变染色体的总数和染色体畸变的细胞数,计算畸变率。

受试物诱发的染色体畸变率较阴性对照有统计学意义的增加,并有剂量-反应关系时记为阳性,同时标明异常细胞出现的频率和种类。
注意事项:
(1)植物性血球凝集素(PHA)具有促使细胞转化的作用,系细胞培养液的重要成分。在培养液中必需加人此成分,其效价直接影响细胞培养成败。
(2)加人阻止细胞分裂的秋水仙素的时间要适当,否则影响收集细胞分裂中期的数目。
(3)培养细胞所需的温度在37℃±0℃之内,否则影响细胞生长和分裂。
(4)在用低渗处理细胞过程中,要注意用吸管吹气,若吹气不够时会影响细胞染色体的分散。
(5)固定时,特别是第一次固定,固定后,接着就用吸管吹气,避免形成集块影响制片。
(6)玻片要干净并冰冻过,当滴上细胞悬液时,要用嘴吹气,将悬液吹散,避免染色体重叠。
所有检出率增高可以反映染色体的畸变情况.细胞出现的频变与对照组相比有统计学意义时记为阳性,Giernsa染色中获得可疑阳性或弱阳性结果的药物,必须有叮吮橙荧光染色以进一步肯定或否定阳性结果,不易通过骨髓屏障的药物,可补充用哺乳动物肝细胞微核试验进一步研究。染色体畸变试验常用有三种:体外培养哺乳动物细胞染色体畸变试验,骨髓细胞染色体畸变试验及翠丸染色体畸变试验。
体外培养哺乳动物细胞染色体畸变试验可用人外周血淋巴细胞和培养的哺乳动物细胞(CHO细胞等)。人外周血淋巴细胞的染色体畸变试验是取肝素抗凝的人静脉血的含有植物凝集素(pHA,促细胞分裂剂)的PRMI1640培养液中培养。采血时淋巴细胞处于G0期,经PHA即植物凝集素刺激后,从开始培养到第一次有丝分裂约需44小时,故应在培养开始的头几小时及36-48小时分别染毒,以检侧受试物分别对GO、G1期和S、G2期的影响。受试物至少设三个剂量组,高浓度为细胞仍能进行有丝分裂的最大耐受浓度,低浓度可为高浓度的1/10,同时设阴性及阳性对照组。在染毒时可加大鼠肝S9混合液作代谢活化系统。细胞在染毒1-2小时后转人不含受试物的培养液中继续培养,收获时间最晚不超过开始培养50-52小时,收获前2小时给以秋水仙碱,使细胞停滞在分裂中期。然后经低渗、固定、制片和染色。油镜观察,每个样品至少分析100个中期相细胞,观察染色体结构和数目的变化,分别计算各组的畸变细胞率,与阴性对照比较,以X2检验其差异的显著性。
动物体内骨髓和睾丸染色体畸变试验多用初成年的啮齿类动物,常用小鼠或大鼠。急性试验为连续二天,每天染毒一次;亚急性试验为连续五夭,每天染毒一次。一般设三个剂量组,高剂量组用1/5-1/10的LD50或最大无作用剂量;低剂量组可用高剂量组的1/10,同时设阴性对照及阳性对照组。各组至少5只动物。于最后一次染毒后6小时处死动物。对骨髓染色体畸变试验,于处死前2小时腹腔注射秋水仙碱,处死取股骨骨髓,离心后再进行低渗、固定、制片及染色。每个动物观察50个中期分裂相细胞,计算每个动物的畸变细胞率,并与阴性对照比较,当t检验表明差别有显著性,且有剂量-反应关系时,则可认为受试物对该种动物的骨髓细胞有致突变作用。
对睾丸染色体畸变试验,于处死前5.5小时腹腔注射秋水仙碱,处死取睾丸,剪碎曲细精管,再经低渗、固定、软化、制片及染色。每个动物做两个皋丸观察50个中期相精原细胞的染色体畸变。统计分析同骨髓染色体分析。对此,也可进行皋丸初级精母细胞的染色体分析。
三、啮齿动物微核试验
啮齿动物微核试验是新药致突变试验(第一阶段)中惟一的一项体内试验,它是细胞培养染色体畸变试验的一项补充与验证。因此,微核试验虽然技术上并不复杂,但它在评价新药的致突变性时,与体外试验的细菌诱变和细胞染色体畸变试验组合成为一项较为科学合理而完整的评价系统。故对准确而可靠地做好微核试验有着重要意义。此外,微核的发生一方面与染色体无着丝点断片或环在细胞分裂,不能定向移动而留在细胞质中。另一方面,纺睡体功能或结构障碍也可能使整个染色体在细胞分裂末期被排人细胞质而形成。故微核试验对染色体完整性受损和染色体分离异常均可能检出。
啮齿动物微核试验:微核试验(The Micronucleus Test)是20世纪70年几代初由Matter和Schrnmid建立的用哺乳动物骨髓红细胞微核的出现率来检测化学物是否具有致突变活性的试验,故比较符合整体实际情况。但有时不够灵敏,不能反映生殖细胞的突变情况,作用于生殖系统的药物需进行显性致死试验。
原理:骨髓细胞经致突物作用,其染色体可发生畸变以至断裂。其断裂的碎片在分裂间期留在子代细胞内形成规则的一个或几个圆形或椭圆形结构的小块物质,由于它比普通细胞核要小,故称之微核。所以观察骨髓细胞中的微核率,有助于检验受试物是否具有致突变作用,但由于骨髓细胞中缺乏代谢活化酶系,对间接诱变物反应较差,具有一定的局限性。
啮齿动物微核试验:
(1)虽然骨髓和外周血液的各型有核细胞均可见到微核,但是在这类有核细胞中胞浆较少,正常的核叶及核的突出物极难以与微粒相鉴别,所以只有在无核的红细胞中才易辨认。在骨髓中无核的红细胞有嗜多染红细胞或称晚幼红细胞(呈灰蓝或浅蓝色)和成熟红细胞(呈粉红或桔红色)两种,正常情况下嗜多染红细胞占多数,由于毒性物质影响了骨髓红细胞尤其是嗜多染红细胞,可使其中的比例失衡,故在骨髓涂片中一般均在嗜多染红细胞中进行观察。同时由于骨髓细胞再生速度较快,微核增多确能反映接蚀致突变物后发生的变异。研究证明,微核检出率和染色体畸变率之间确有明显的相关性。
(2)动物《指导原则汇编》中推荐首选NIH小鼠,有的地区可能无此种小鼠,可改用国内常用的其它品系小鼠。
关于动物的选择,要求健康性成熟小鼠,试验一般首推NIH小鼠,体重未作具体要求,但为便于取骨髓制片,一般体重在20-24g较为适宜。
关于动物数与性别要求,实验要全部用雄性,每一剂量组至少6只;若雌雄兼用,则每组为10只,雌雄各半。
从动物中心领取或购买的小鼠,一般应在实验室饲养3-5天,使其适应新环境并注意观察并剔除不健康的动物。
(3)给药剂量;剂量设计是毒理学研究中的一个非常重要的间题。一般小鼠的微核试验至少采用3个剂量,最高剂量以1/2LD50为基准,否则应说明选择剂量的理由。要求最高剂量达到1/2LD50是为了尽可能发现药物本身可能具有的毒作用。另一方面,低剂量组的设计则应考虑药效学试验结果或人临床拟用剂量,即是说低剂量的设计就是有效剂量或临床拟用剂量。当最高与最低剂量一经确定后,中间剂量即可按一定比例设置。
新药剂量设计的另一原则与方法,就是完全参照其临床拟用剂量来设计,这种情形在实际工作中并不少见。至于小鼠微核试验的剂量设计,高剂量组也可考虑用临床剂量的100倍或以上,若存在某些理由或实际困难,应不低于临床拟用剂量30-50倍,否则难以说明试验结果的实际意义。
(4)给药途径与方法:小鼠微核试验给药途径应尽可能和临床拟用途径相同。但也有少量例外的情况,例如某些外用新药,如经皮肤给药,会存在给药剂量的准确性问题,通常可考虑采用肌内或皮下途径给药来代替。
关于给药频率,一般情况下均按剂量一次给药,若有恰当理由,也可采用诱导或多次给药方法。
(5) 对照组设置:必须设阴性(空白)、溶剂和阳性对照。
阳性对照在微核试验中是必不可少的,用已知的阳性药物事得肯定的阳性变化,可以表明试验所用动物的反应性及试验条件的可靠性,反之,则应视为试验的失败,应查明原因并再次试验,直到获得肯定的结果。
最常使用的阳性药物为环磷酞胺,只要剂量选择恰当,几种常用给药途径均能诱发微核率升高,且有剂量效应关系。
(6) 骨髓采样时间:通过预试,在12-72小时不同时间内,取5个作用点,找出合适采样时间处死动物取骨髓样本观察核微率情况。若给药后各时间点的核微率无显著变化,则通常可采用给药后24小时处死动物采集骨髓。
(7) 骨髓直接涂片法:
① 小鼠脱颈椎处死(大鼠断头处死)。将鼠固定,来苏冲洗,切开皮肤、肌肉,取出股骨二根(大鼠一根),用纱布擦净,纵形剪去股骨1/4-1/3,用大头针或针头挑出骨髓,放在已滴好一小滴小牛血清的载玻片上.(血清宜滴在载玻片的一端),另取一块边缘整齐的载玻片,在血清上轻轻按摩,让骨髓团块完全分散均匀,然后以45-50度角快速推片,在空气中晾干。
②固定:将涂片放人甲醇中固定5---10分钟,待干后进行染色或保存数月或至数年后再染色。
③染色:将涂片置于应用液中,染色10-30分钟(视室温而容,室温高染色时问可短些,室温低所需时间则长些)。取出染片用pH6-8磷酸盐缓冲液反复冲洗,或用自来水冲洗破片,再用蒸馏水冲洗,在空气中晾干或37℃恒温箱中烘干。
④封片:如长期保存时可将晾干或烘干的染片放人二甲苯5-10分钟,取出滴上一滴光学树脂胶,封上盖玻片,注意切勿有气泡。
另外还有离心法制作标本。
(8) 微核的观察与鉴别:典型的微核是单一的,呈圆形,边缘光滑整齐,嗜色性与核质一致,直径相当于红细胞直径的1/20-1/5-,偶有肾形,环形等,用Giemsa染色后,微核呈紫红色或兰紫色。
先用低倍镜、高倍镜粗检,以有核细胞形态完好作为判断制片优劣的标准,选择细胞分散均匀、细胞完整、染色好的区域,再换成油镜计数。每只动物至少观察计数1 000个嗜多染红细胞,观察其微核出现的频率及嗜多染红细胞中出现两个或更多个微核,仍按一个微核细胞计算。
镜检时,嗜多染红细胞和成熟红细胞。由于它们有着不同一般是可区别的。但是由于骨髓细胞始终处于幼稚到成熟不断发展的过程。红细胞的着色也是由蓝变红的,所以有时难以区别这两种红细胞,在这种情况下就不一定区分两种红细胞而计数红细胞中总的微核率即可。
(9)制片及镜检中的注意点:骨髓直接涂片法关键在于让细胞分散均匀,推片技术要求熟练,否则,细胞易成堆,影响观察,对于初学者每只鼠适当地多涂几片,以供挑选,如细胞分布很不均匀或细胞变形破碎就弃之不用。涂片染色后,先滴上几滴二甲苯,在显微镜下观察细胞分布着色情况,如着色太淡,可置人Giernsa应用液中重染。
镜检时有时会发现类似微核的人为异物,其主要来源于染料的颗粒和骨髓细胞破碎的颗粒,大小,染色可能与微核非常类似。这些颗粒往往数目较多,外形不规则,杂乱无章地分布于各类细胞上面,观察时应小心加以鉴别。
(10) 结果判定:正常情况下,骨髓嗜多染红细胞中微核的检出率小鼠为0.4%左右,大鼠为0.2%左右,如遇致突变物质,微核的检出率可显著增加,由于微核是染色体畸变断裂所造成的结果,所以微核检出率增高可以反映染色体的畸变情况,微核细胞出现的频率与对照组相比有统计学意义时记为阳性,Giexnsa染色中获得可疑阳性或弱阳性结果的药物,必须用吖啶橙荧光染色以进一步肯定或否定阳性结果,不易通过骨髓屏障的药物,可补充用哺乳动物肝细胞微核试验进一步研究。
近年来国内外学者对微核试验在方法学上进行了不少的探索和改进。上述的骨髓嗜多染红细胞微核测定法具有简便、经济、快速、可靠等优点,仍是当今各种微核测定法中的一种首选方法。然而,由于它取样于骨髓,不能对实验动物作多次取样实验,难以观察化学物质在体内产生致突变作用的强度和持续时间,所以有人提出外周血淋巴细胞微核测定法可能弥补骨髓嗜多染红细胞微核测定法的不足,但此法又具有敏感性低,判断微核准确性较差,取血量多,操作繁琐等缺点。1988年陈世明等建立了一种快速检测外周血嗜多染红细胞微核的新方法,即常规制备皿片,用0.1%叮咤橙染色,于荧光显微镜下观察,作者认为此法与骨髓嗜多染红细胞微核测定法相比,不仅具有类似的敏感性和可靠性,而且具有更快速(在制备标本方而快15倍,在镜检方而快3倍)。更简便,更经济,能在同一动物体内反复多次进行实验,以观察化学物质诱发微核作用高峰时间和作用持续时间的优点。其缺点是染色后标本不能永久保持,以及不能检测嗜多染红细胞与成熟红细胞的比值。随着研究的不断深入,这些研究方法和手段也将会更加完善。
四、啮齿类动物显性致死试验
原理:动物显性致死试验是观察哺乳动物生殖细胞染色体损伤的一种方法。生殖细胞在减数分裂期和受精期最易发生突变,突变后失去与异性生殖细胞结合的能力或者结合后会出现发育不正常的胚胎,以致造成总着床数减少或早期胚胎死亡及畸胎等现象。常用性成熟的雄性小鼠15只,孕鼠20只以上。
一般设三个剂量组,最高剂量约为
经适当的统计学分析,如平均活胎数显著减少,平均死胎数显著增加,有一个或多个死胎的母鼠数增加三项标准中有两项达到要求,即可判为阳性。分析各周交配的显性致死情况,可检出精子是处于哪个发育阶段受到遗传毒作用。染毒后头3周交配的结果表示对精子和精细胞的作用。第4-5周交配的结果表示对精细胞的作用,第6周及以后的结果表示对精原细胞和干细胞的作用。
此法在动物体内进行,不需要特殊设备,观察容易,结果明确,能反映遗传损伤的直接后果,是一种较为实用的方法。缺点是只在严重突变时,才能引起胚胎死亡。因此,不够灵敏,而且只限于观察生殖细胞。
五、 DNA损伤试验
姐妹染色单体交换试验(Sister-chromatid exchange, SCE)
SCE是染色体同源座位上DNA复制产物的相互交换,SCE可能与DNA的断裂和重接有关,提示DNA损伤。细胞在含5-溴脱氧尿苷(Brdu)的培养液中生长两周期,Brdu可取代胸腺嘧啶掺入DNA。在第一个细胞周期,染色体的两条单体各有一条DNA链掺人Brdu,此时两姐妹染色单体之间染色没有区别,但到了第二个周期的分裂中期,染色体的一条单体保留了原来不含Brdu的模板链,而另一条是以第一周期中掺人Brdu的新合成链为模板链。这样,两条姐妹染色单体内夹着深浅不同的染色体片段而被识别和计数。SCE试验可选入周围血淋巴细胞,培养的哺乳动物细胞(CHO等)。人周围血淋巴细胞的培养,染毒等过程同染色体畸变试验,在细胞培养2小时后,加入Brdu,然后过66-78小时加秋水仙碱,收获、低渗、固定、紫外线照、加吉姆萨染色,每个剂量至少观察50个中期细胞。在有SCE的染色体上计数在一个染色单体中染色深浅转变的数目,即为该染色体的SCE次数。计算各剂量组每个细胞平均SCE数及标准差,与对照组比较,用单侧t检验进行统计分析。当差别有显著性,并有剂量一反应关系时,可判结果为阳性。
SCE试验方法的优缺点:SCE是一种相当简易,加速和灵敏的检测诱变剂的方法。能很好地检出产生DNA加合物(adducts)的化合物,如烷化剂,它不仅能检出强的致癌性诱变物,也能检出像塘精那样弱的诱变剂和弱致癌剂。
但形成SCE的机理未明,SCE虽可作为DNA损伤的“信息”, 但只能反映损伤的很小一部分。如SCE试验对能诱导DNA双链断裂的博莱霉素相当不敏感,对需要反复慢性接触的致癌物也不敏感。当化合物低达靶组织前,活化不充分或物质有反应性都可导致假阴性。因此,SCE阳性反应较阴性反应具有更大意义。阳性结果一般表明化合物是诱变性的致癌剂(因有少数假阳性)。