第十五章 基因重组与基因工程
第一节 自然界的基因转移与重组
一、基因重组(Gene re-arrangement,recombination)及主要方式
(一)基因重组
是指整段DNA在细胞内或细胞间、甚至在不同物种之间进行交换,井能在新的位置上复制、转录和翻译。是自然界常见的现象。
(二)基因重组有多种方式。
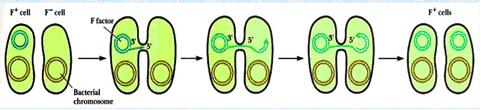
1.接合作用(conjugation)
指当细胞与细胞或细菌通过鞭毛相互接触时,质粒DNA就可以从一个细胞(细菌)转移到另一个细胞(细菌)。此种类型DNA转移称为结合作用。
只有某些较大的质粒(如F因子:编码细菌性鞭毛蛋白)DNA才有此转移能力。
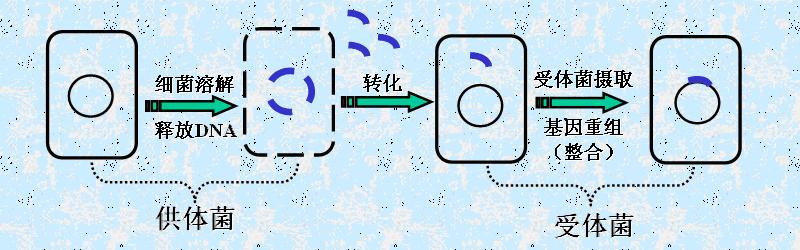
2.转化(transformation)
是指外来DNA导入细胞(自动获取或人为供给)后,引起细胞生物类型(遗传表型)改变的过程。例如:溶菌时DNA转移,受体菌获得新性状。(自然界转化率极低)。
(1)转染(transfection)
是指嗜菌体感染宿主菌细胞,将其核酸导入菌体的过程,是转化的一种形式。
(2)整合(integration)
导入宿主细胞的外源DNA可以独立存在,也可以与宿主的染色体重组,成为宿主染色体的一部分。后者称为整合,是转染的一种。
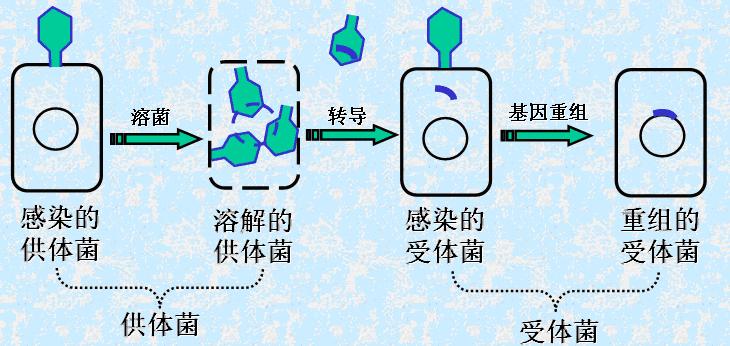
3.转导(transduction)
是指借助噬菌体将宿主细胞的基因信息(转导基因,DNA)从一个细胞导入另一个细胞(溶源菌生长途径)。
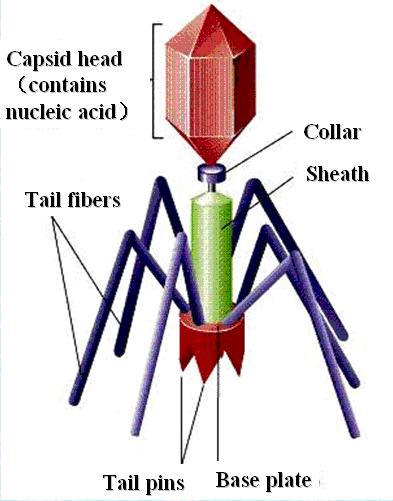
下图为噬菌体的结构及其介导的转导过程示意图。
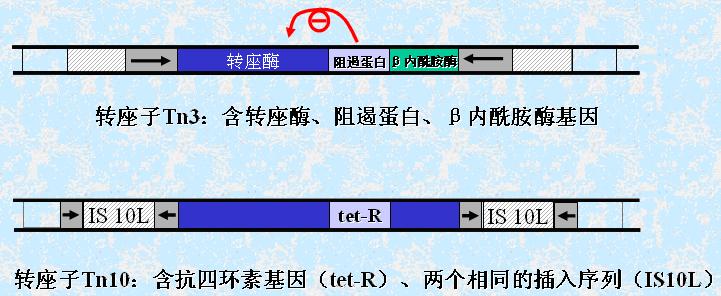
4.转位(座)(transposition)
由插入序列和转座子介导的基因移位或重排称为转座,是指—个或一组基因从基因组的一处转移到另一处。
可转移的游动基因或DNA序列包括插入序列和转位(座)子。
(1)插入序列(insertion sequence):
长750~1500bp的DNA片段。包括:
1)两个分离的、由9~41bp构成的反向重复序列(inverted repeat; IR)
2)IR的侧翼是短的(4~12bp)正向重复序列——不同的插入序列所特有的。
3)一个转座酶(transposase)编码基因。
由插入序列发生的转座包括2种形式:
1)保守性转座(conservative transposition):插入序列原件从原位到新位。
2)复制性转座(duplicative transposition):插入序列复制后副本迁到新位。
(2)转座子(transposon,Tn ,transposonS):
可以从一个染色体位点转移到另一位点的分散的重复序列。
转座子以两个反向重复序列为侧翼并含有转座酶基因。与插入序列不同的是:它含有抗生素抗性基因。许多的侧翼序列本身就是插入序列。
(三)基因重组的类型
1.位点特异的重组(site-specific recombination)
由整合酶催化、在两个DNA序列的特异位点间发生的整合。
如:反转录病毒的整合酶可以特异性识别、整合反转录病毒的长末端重复序列(LTR)入宿主细胞的基因组。转座酶可以特异低识别转座子的反向末端重复序列发生位点特异的整合(重组)。
2.同源重组(homologous recombination(基本重组:general recombination)
发生在同源序列间的重组。该重组不需要特异的DNA序列,而是依赖两分子的同源性。
如果通过转化或转导获得的外源DNA与宿主DNA充分同源,则外源DNA就可以整合进入宿主的染色体。同源重组可以发生在原核或真核生物。
目前对E.coli的同源重组了解的最清楚,此过程需要重组蛋白。
第二节 重组DNA技术
一、重组DNA技术相关概念
(一)DNA克隆
1.克隆(clone)与克隆化(cloning):
(1)克隆是来自同一始祖的相同副本或拷贝的集合。即无性繁殖系(动植物、细胞、分子)。
(2)克隆化是指获取克隆的过程。即无性繁殖或建立无性繁殖系。
“克隆”即是无性繁殖的意思。在生物学领域有几个不同层次的含义。
(1)DNA克隆(DNA cloning)也叫分子克隆(molecular cloning)基因克隆(gene cloning)
含义是将某一特定DNA片段通过重组DNA技术插入到一个载体中,然后在宿主细胞中进行自我复制所得到的大量完全相同的该DNA片段的“群体”。
(2)细胞克隆
是指由一个单一的共同祖先细胞分裂所形成的一个细胞群体。
1)一个细胞在体外培养液中分裂几代所形成的完全相同的细胞集体为一个细胞克隆。
2)在脊椎动物体内由同一个B细胞分裂而来、产生同一特定抗体的所有浆细胞群体也是一个细胞克隆。
(3)个体克隆是指基因完全相同的两个或更多的个体组成的一个群体。
1)两个同卵双胞胎即为一个克隆;来自同一个受精卵细胞,遗传背景完全一样
2)通过细胞核移植所得到的一个遗传背景完全相同的动物或植物也是一个克隆。
如1998年英国科学家将小鼠卵丘细胞的细胞核移植到去除了细胞核的卵母细胞中后,得到了20多只发育完全的小鼠,这些小鼠群体就是一个克隆。
关于“克隆”,最广为人知的是英国维尔穆特领导的12人小组,运用克隆技术,于1997年成功地“复制”出的第一只绵羊“多利”。
哺乳类一般都是有性繁殖。最先是由卵巢中的卵原细胞(具有双倍的遗传物质的二倍体细胞)经过数次分裂,最终成为单倍体(只含体细胞一半的染色体)的成熟卵细胞。但成熟卵细胞还不能发育成为一个新个体,它必须受精(与单倍染色体的精子结合)成为双倍体的受精卵,才能继续发育形成一个新生命。
目前克隆哺乳动物的方法由简单到复杂有以下几种:
(1)胚胎分割。
将未着床的早期胚胎用显微手术多次分割后分别移植给受体体内让其妊娠产仔。
由一枚胚胎产生两个以上的后代,遗传性能完全一样,但并非严格意义上的“克隆”。目前用此法已克隆出小鼠、家兔。山羊、绵羊、猪、牛和马等。
(2)胚胎细胞核移植。
将已着床的早期胚胎用显微手术的方法来分离单个细胞,导入去除核的未受精成熟卵母细胞,让该卵母细胞质和导人的胚胎细胞核经过电融合,分裂、发育为胚胎。把该胚胎移植给受体,让其妊娠产仔。
目前此法克隆的动物有小鼠、兔、山羊、绵羊、猪、牛和猴子等。
(3)胚胎干细胞核移植。
将胚胎或胎儿原始生殖细胞经过抑制分化培养,让其细胞数成倍增多但不分化,每个细胞仍具有发育成个体的能力。把该单个细胞利用核移植技术,将其导入除去染色体的成熟的卵母细胞内克隆胚胎,经移植至受体,妊娠、产仔、产生克隆动物。
(4)胚胎嵌合。
把两枚胚胎细胞(同种或异种动物胚胎)嵌合,共同发育成为一个胚胎,称为嵌合胚胎。再将该胚胎移植给受体,妊娠产仔(嵌合体动物)。
如同种黑鼠和白鼠胚胎细胞嵌合,生下黑白相间的花小鼠。
不同种的绵羊和山羊胚胎细胞嵌合,可生下绵山羊,既有绵羊的特征,又有山羊的特征。
目前嵌合体动物有小鼠、大鼠、绵羊、山羊、猪和牛等;种间嵌合体动物有大鼠一小鼠嵌合体,绵羊一山羊嵌合体、马一斑马嵌合体,牛一水牛嵌合体。
(5)体细胞核移植。
把动物体细胞经抑制培养,使处于休眠状态,取其细胞核导人去除染色体的成熟的卵母细胞克隆胚胎,经移植受体,妊娠产仔,克隆出动物。比如克隆绵羊“多利”。
2.几个同义词——都指的是“克隆化”的过程,又都有名词“方法或方法学”的含义
(1)分子克隆(molecular cloning)
(2)DNA克隆(DNA cloning)
(3)基因克隆(gene cloning)
(4)重组DNA(recombinant DNA)
(5)基因工程(genetic engineering)
都是指:
1)在体外应用酶学的方法将各种来源的DNA分子与载体DNA结合成具有自我复制能力的重组体DNA分子(复制子);
2)将重组体DNA分子转化或转染入宿主细胞、筛选含有目的基因的转化子细胞;
3)将转化子细胞培养、扩增、提取,获得大量同一个DNA分子。
简单地讲:就是按照人工的设计实施基因重组的技术、获取DNA克隆的过程。
3.重组DNA工艺学(recombinant DNA technology)或基因工程(genetic engineering)
实现基因克隆所采用的方法及其相关的工作的统称。
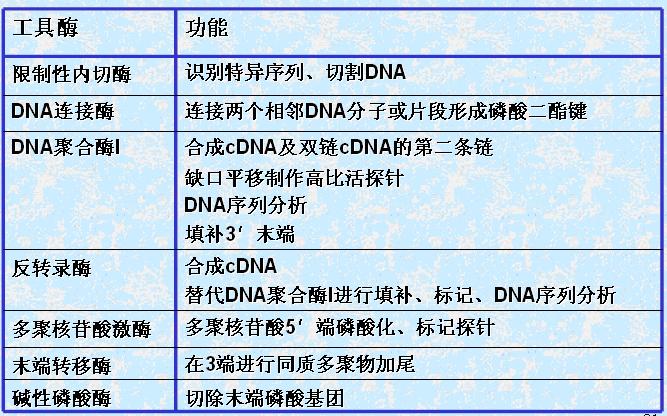
(二)工具酶(如下表)
1.限制性核酸内切酶(限制酶)
是一类能识别双链DNA分子中特异核苷酸序列,并在识别位点或附近切割双链DNA的内切酶。
此酶存在于细菌体内与甲基化酶共同构成细菌的限制-修饰体系,限制外源DNA、保护自身DNA,稳定其遗传性状。同时也是基因工程中重要的工具酶。
根据酶的组成、所需因子及其DNA方式不同分三类,重组DNA技术常用的是II类酶。(其它两类酶同时具有限制与修饰功能,并且I类酶对DNA的切割是随机的)。
(1)限制酶的特点:
1)均来自微生物,并以其来源的微生物学名进行命名;
2)特异识别连续的4、6或8个碱基;按其识别顺序可以计算切割几率:
假定四种碱基在DNA链上随机分布,则识别4、6、8个碱基顺序出现的几率分别是1/44、1/46、1/48(识别顺序出现的碱基间隔)。识别序列越长、切点越少。
3)识别序列大都具有回文结构(palindrome),即识别序列呈二元旋转对称。
(回文结构多数不是重要的结构基因)。
4)经其切割后的DNA可产生不同的末端:包括:
平头末端(blunt end)或钝性末端
粘性末端(sticky end ;或 cohesive end)
在两链上切点对称错开。
有互补单链区的:3'切或5'末端突出的粘性末端(分别从3′端和5′端切割)。
配伍末端(compatible end):
识别序列不完全相同的限制酶切割后产生的相同类型的粘末端。
现在已经提纯的限制酶400多种。如:EcoRⅠ、BamHⅠ等。
5)存在几种特殊的II型酶:
同裂酶(异源同工酶)——来源于不同微生物、识别相同序列,切点可以相同或不同。
同尾酶——来源不同、识别序列(甲序列包含乙序列)和切点有相关性、产生相同末端。
可变酶——识别顺序中的一个或几个可以变化。如:Bstp I识别顺序:GGT(N)ACC。
(2)限制酶应用的注意事项:
1)要求DNA纯度
2)需要镁离子和TE缓冲体系,体系中加二硫苏糖醇或巯基乙醇防止酶氧化。盐浓度有高、中、低三个级别
3)温度通常要求37℃(个别50-65℃)
不符合活性的条件回导致酶的识别序列放宽(产生星活性)。具体参考厂家说明。
(三)目的基因(target DNA)
1.目的基因:又称外源基因。即欲分离的感兴趣的基因或欲表达的基因。包括2类:
(1)互补DNA(Complementary DNA,cDNA)
是指经反转录合成的、与RNA(通常是mRNA或病毒RNA)互补的单链DNA。
(2)基因组DNA
是代表一个细胞或生物体整套遗传信息(染色体及线粒体)的所有DNA序列。
2.获取目的基因的方法:
(1)直接从组织或细胞染色体DNA中分离,限制性酶切;
(2)利用DNA合成仪化学法合成,或用PCR法扩增;
(3)提取mRNA反转录合成cDNA直接克隆,或建立c-文库再从中筛选。
(4)利用鸟枪法建立G-文库,再核酸探针从基因文库中“钓”取。
(5)PCR方法
3.基因文库:
提纯生物体全部DNA,用限制性内切酶随机切割成大致相同的数以万计的片段,重组入同一类载体上,转化宿主菌保存,即得基因文库。
(1)用基因组总DNA制备的基因库叫G-文库;
(2)用细胞全部mRNA经反转录制备全套cDNA后建立的基因库,则称c-文库。
(四)基因载体
1.基因载体(克隆载体)(cloning vehicle; cloning vector):
指为“携带”外源DNA并实现其在宿主细胞中的无性繁殖或表达所采用的小分子DNA。
2.表达载体(expression vector):
为使插入的外源DNA序列可以转录、翻译出多肽链而设计的克隆载体又称为表达载体。
3.理想的基因载体应具备以下条件:
(1)可在宿主细胞内自行复制(具有自身的复制子并能携带外援DNA一同扩增);
(2)有多种限制性核酸内切酶的单一切割位点(多克隆位点);
(3)载体分子应尽可能小,可插入较大的外源DNA而不影响复制;
(4)有一定的筛选标记(抗药性、酶基因、营养缺陷型、形成嗜菌斑等)。
(5)拷贝数多、与宿主易于分离、抗剪切力强。
(6)表达型载体应配备与宿主细胞适应的启动子、前导顺序、增强子等。
4.常用的载体有质粒DNA、噬菌体DNA和病毒DNA等。
(1)质粒plasmid
是存在于细菌染色体之外的小型环形双链DNA分子,大小为1—200kb不等。
质粒能在宿主细胞中独立自主地复制,并携带某些遗传信息、赋予宿主细胞一些遗传性状,便于筛选转化子细菌。如对某些抗生素的抗性等。
需要选择天然松弛型质粒(复制不受染色体复制功能的控制)而非严紧型质粒。并且多数需要经过人工改造。
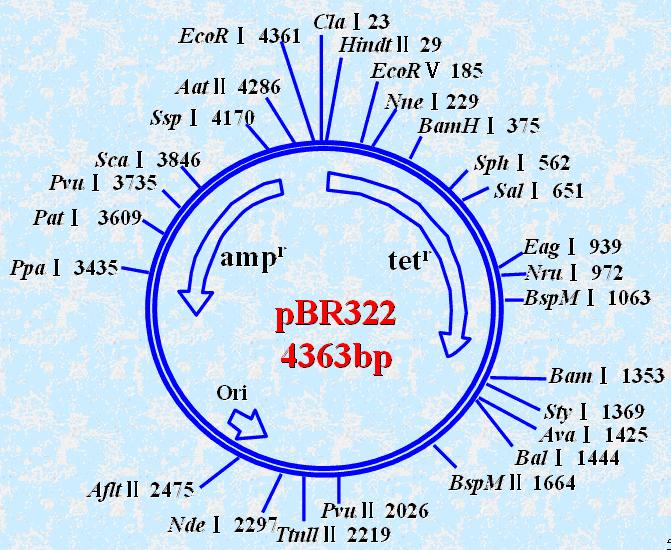
常用的质粒载体如pBR322:大小约为4kb,含有单个EcoRI酶切位点,可以插入外源基因。含有耐氨卞青霉素基因(amp-r)和耐四环素基因(tet-r),可以作为筛选标志。
图解说明:
12点钟为0,顺时针方向增大的数字——酶与酶切位点,箭头表示重要的标记基因。
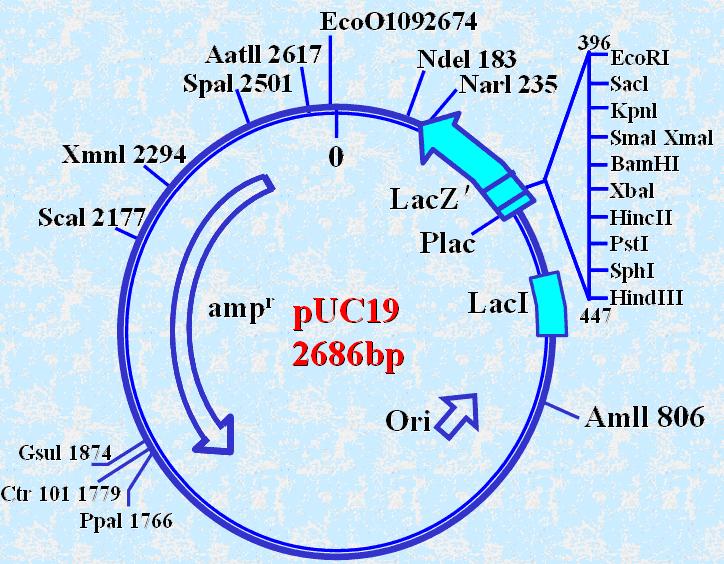
pUC系列也是常用载体,含有Pvu II/EcoR I切点和amp-r基因以及与M13mp相同的多克隆位点。其衍生的pGEM系列带有特殊的启动子(控制噬菌体RNA-pol的转录单元)。
(2)λ噬菌体、M13噬菌体——多经过改造
1)λ噬菌体:线性双链DNA分子,大小约50kb。在两端各有12bp的互补单链,是天然的粘性末端(COS位点)。特点是非生长必需基因占30%,可以插入外源基因(长度可以在载体自身的70%——105%)。
在宿主细胞内,λ噬菌体可以有裂解和溶原两种生活方式。
λ噬菌体→λgt系列:插入型载体(多个可以插入外源基因位点),适用于cDNA克隆。
λ噬菌体→EMBL系列:置换型载体(多对限制酶双切点供外源基因置换或取代),适用于基因组DNA克隆。
2)M13噬菌体:丝状噬菌体,闭和环状正链单链DNA(ssDNA)是其感染型,而复制型DNA(RFDNA)是双链(dsDNA)。
M13→M13mp系列、pUC系列
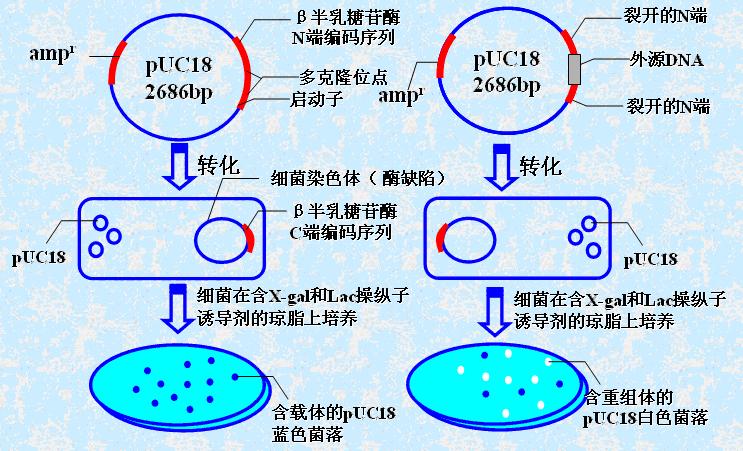
M13噬菌体改造:
间隔区插入E.coli的调节基因和LacZ(编码β半乳糖苷酶的α片段,N端146氨基酸)。
突变型Lac—E.coli可以表达β半乳糖苷酶的ω片段(C端)。只有与β半乳糖苷酶的α片段(N端)共同存在时才有β半乳糖苷酶的活性。
α互补(alpha complementation):筛选标记的依据
宿主与克隆片段同时表达α片段和ω片段时宿主细胞才有β半乳糖苷酶的活性,使特异的作用物转变为兰色。
若外源基因插入pUC的LacZ基因→感染Lac—E.coli→LacZ不表达→X-gal培养→白
若外源基因未插入pUC的LacZ基因→感染Lac—E.coli→LacZ表达→X-gal培养→蓝
(3)其它载体
1)柯斯质粒或称粘粒(cosmid vector):质粒+噬菌体。具有二者的双重特性
2)酵母人工染色体载体(yeast artificial chromosome;YAC):大容量的载体。
3)病毒改造的载体:真核重组及其表达载体、基因治疗载体。
DNA病毒:SV40(猴肾病毒)、痘苗病毒
RNA病毒:反转录病毒、植物病毒
昆虫病毒:具有宿主专一性强特点,既能表达原核基因、又能表达真核基因。
二、重组DNA技术的基本原理或步骤
包括:目的基因的获取(如前)、克隆载体的选择和构建(需要根据目的和操作基因的性质进行)、目的基因与载体共价连接形成DNA重组体、DNA重组体导入宿主细胞及(无性繁殖)、对合有DNA重组体的宿主细胞(阳性克隆)进行筛选和签定、克隆基因的表达。
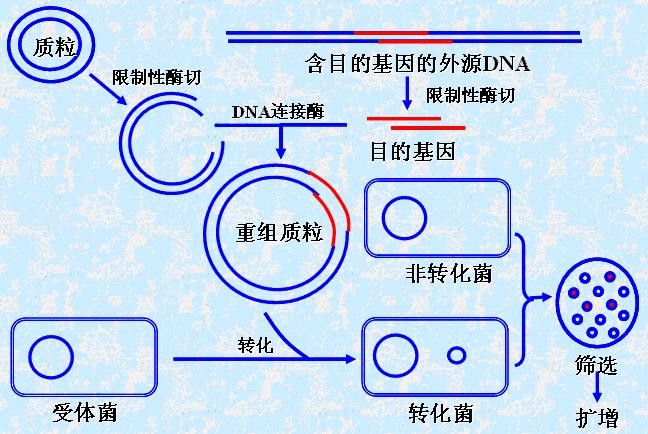
其流程概括起来包括分、切、接、转、筛等步骤。下图是以质粒为载体的DNA克隆过程。
(一)分——分离目的DNA和构建好的载体
(二)切——用限制性核酸内切酶分别切割目的DNA和载体
(三)连——用DNA连接酶将目的基因与载体共价连接形成DNA重组体
目的基因与载体的连接方式根据不同限制酶切割产生不同的缺口而不同:
1.直接连接:
(1)用同一种限制酶分别切割载体及目的基因后,无论产生的是平端切口或粘端切口,都可用DNA连接酶将二者直接连接。
其中粘性末端连接简单高效,但是会产生载体自身退火连接或载体之间连接再成环,产生假阳性的转化菌。可以用高浓度外援DNA和切除载体5′磷酸方法弥补。
另外,用同样酶切割载体和外源DNA有时发生反向插入而不表达。可以用两种酶切的方法解决(使二者各有1个同种酶切的相同末端。如载体H——B、外源基因H——B)。
载体用2中酶切→电泳去除切点中间的片段→与用同样2种酶切的外援DNA连接。
(2)不同限制酶切产生的配伍末端可以直接连接。
(3)不同限制酶切产生的平端。
2.尾接法:
如果载体和目的基因无共同的酶切点时,可先用单链核酸酶将各自的粘端切平,然后在末端核苷酸转移酶作用下,催化脱氧单核苷酸(如polyC与polyG或polyA与polyT)分别添加于目的基因与载体的3'-OH末端(只能是此末端),形成多聚物互补单链序列。即在DNA片段末端加上同聚物序列以制造出粘末端,再进行粘性末端连接。
3.人工连接器(连接子):
对于平端DNA片段或载体DNA可以在连接前将磷酸化的接头或适当分子(人工合成含有常用限制酶识别序列的双链DNA短片段)连接到平末端,使之产生新的限制酶切点,再用识别新位点的限制酶切除接头的远端产生粘性末端。
即将含有常用限制酶识别序列的双链DNA短片段(连接子)分别连接于载体及目的基因上,制造二者共有的酶切点,以便于连接。
需要说明的是在连接反应体系中DNA片段不同末端相互竞争会产生不同构型的产物:
1)线形连接物——各DNA分子首尾相连成线形
2)环状连接物——同一分子末端连接成环、先形成线形分子再连接成环。
所以成功的克隆,必须有正确纯净的外源DNA成分,相对应的末端浓度和适宜的连接产物。可以调整插入片段和载体的比率(3:1或4:1到5:1):公式如下
插入片段量(ng)=载体含量(ng)×片段与载体长度比例×片段与载体分子数比例
(四)DNA重组体导入宿主细胞及—无性繁殖
将重组DNA导入受体菌。受体菌的要求:
1)容易接纳重组分子
2)对载体的复制扩增无严格要求
3)不存在特异的限制-修饰酶体系降解或修饰外源DNA
4)符合“重组DNA操作规则”的安全标准。
受体菌多数由大肠杆菌K12改造而来。并且应该是限制酶和重组酶缺陷型。依实验目的不同,宿主细胞也可以是真核细胞。
常用的方法有转化(质粒)、转染(噬菌体和病毒)和感染:包括三种方法
1.物理方法
(1)纤维注射——受体细胞为较大的细胞(卵细胞)。转基因动物常用。
(2)电穿孔法——高压脉冲电场作用使细胞膜出现瞬间可逆的小孔使外源DNA进入。
此方法广泛用于各种细胞的基因转移(细菌、酵母、植物、动物)。
优点是简便、重复性好、转移效率高(尤其是对于酵母和细菌)、转染DNA的突变率低。缺点是对细胞损害大,有时造成细胞死亡。多数用于克隆基因的短暂或持续表达。
一般条件:最高场强250——8000V/cm,持续时间10-6——10-3秒。
(3)基因枪法——将DNA吸附到高黏度微小的金属颗粒(钨和金)上,用特殊的颗粒加速装置(化学爆炸、压缩气体等)将其射入细胞或组织。
此法应用的细胞广泛,但是装置特特殊,故应用不广。
2.化学方法
(1)氯化钙转移法——使宿主细胞处于0—4℃氯化钙低渗溶液中而膨胀,经42℃短时间温育,使细胞膜的通透性加大(感受态形式),重组DNA易于导入。
离心收集对数生长期的细菌→加入1/2原培养液体积的氯化钙(50—100mmol/L)悬浮细菌→离心后用1/5原培养液体积的氯化钙在悬浮一次→按比例加入重组DNA溶液中→0℃放置30分钟→42℃热冲击90秒后快速冷却→加适量LB培养液37℃使细菌复苏→固体培养基上筛选转化菌。
此法适用于多数的大肠杆菌的转化,效率可以满足克隆需要。
(2)碱金属离子转移法、DNA-磷酸钙共沉淀法、二乙基氨基葡聚糖法、脂质体转染法、原生质融合法等。
3.生物学方法
(1)将λDNA重组体与λ噬菌体的头尾部蛋白混合,组装成有感染性的完整颗粒,再用于感染宿主细胞。
(2)病毒转染法。
(五)筛——对合有DNA重组体的宿主细胞(阳性克隆)进行筛选和签定
在转化过程中,并非每个细胞都含有目的基因。因此,须在不同居次不同水平上进行筛选和鉴定。有直接选择法和非直接选择法(免疫学方法)。
1.直接选择法
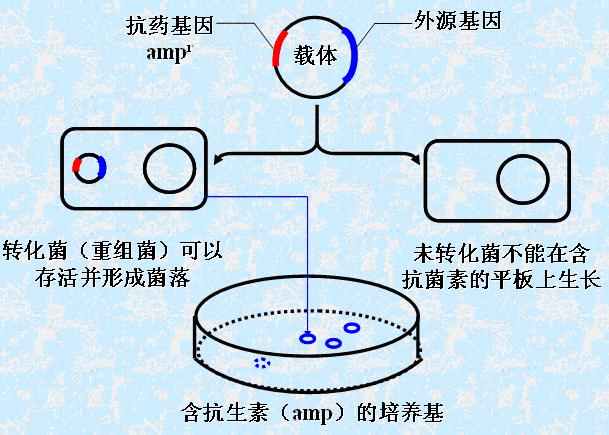
(1)表型筛选:
带有筛选标记基因的DNA重组体的导入使宿主细胞的某些表型,如耐药性、营养素依赖性等发生改变。
还有以下情况:
1)插入表达——转化细菌插入后表达(非转化菌不存活)。
如质粒pTR262来自噬菌体的CI基因(抑制tet-r表达)被外源基因插入后失活而去除对tet-r的抑制,使tet-r表达对四环素的抗性。
2)插入失活——通过有、无抗菌素的培养基可区分含单纯载体和重组载体的转化菌。
(2)标志补救:
若克隆的基因能在宿主菌表达,且表达产物与宿主菌的营养缺陷互补,就可以利用营养突变菌株筛选。
α-互补也是一种标志补救,可以作筛选的标志(β-半乳糖苷酶显色反应)。
在LacZ不被插入失活情况下,有底物生色剂X-gal(5-溴,4-氯,3-吲哚β-D-半乳糖苷酶)和诱导物IPTG(异丙醇-β-D硫代半乳糖苷)存在下菌落呈现兰色。
LacZ插入外源基因后菌落呈现白色。
下图为利用α-互补筛选重组体pUC18的原理示意图。
(3)限制酶图谱筛选:
重组体DNA与原载体DNA经适当地限制酶切割后可产生不同的DNA片段,经电泳可鉴定。
(4)核酸杂交筛选:
利用与目的基因有互补序列的、带有放射性标记的特异核酸探针,经菌落培养、原位杂交和放射自显影,可鉴定出阳性重组体。
(5)直接快速抽提质粒进行电泳可以筛选转化子。
2.非直接选择法(免疫化学筛选)
如目的基因能在宿主细胞内表达、合成外源蛋白质,可用相应的特异性抗体来检测目的基因编码的外源蛋白质(抗原)。
次方法选择性强、特异性高,灵敏度好,尤其适用于不为宿主菌提供任何标志的基因。
(六)克隆基因的表达——蛋白质表达
1、原核表达体系
E.coli是目前采用最多的原核表达体系。
运用E.coli表达有用的蛋白质必须使构建的表达载体复合下列标准:
1)含大肠杆菌适宜的筛选标志;
2)具有能调控转录、产生大量mRNA的强启动子;
3)含适当的翻译控制序列;
4)含合理设计的多接头克隆位点。
实际工作中依表达目的而策略不同。
E.coli原核表达体系在实际应用中的不足:
1)缺乏转录后加工机制,该体系只能表达cDNA而不宜表达真核基因组DNA
2)缺乏适当的翻译后加工机制,表达的真核蛋白质不能形成适当的折叠或进行糖基化。
3)表达的蛋白质常形成不溶性的包涵体,使其有活性需要进行复杂的复性处理。
4)该体系很难表达大量的可溶性蛋白。
2、真核表达体系
可以是酵母、昆虫、哺乳类动物细胞。尤其是哺乳类动物细胞。
克服了E.coli表达体系的缺点,但是也有不足之处:操作技术难、费时而不经济。如何将克隆的重组DNA导入哺乳类动物细胞是关键。
将表达载体导入真核细胞的过程称为转染。
常用的细胞转染方法有:
磷酸钙转染、DEAE葡萄糖介导转染、电穿孔、脂质体转染、显微注射等。一般大多数细胞都可以采用前二者进行瞬时转染,大的细胞可以进行显微注射。
三、重组DNA技术与医学的关系
发现致病基因、发展生物制药、基因诊断与治疗、遗传病的预防。
(一)疾病基因的发现
(二)发展生物制药
生产有药用价值的蛋白质、多肽是当今世界的一大产业。已经有多种产品投放市场。
(三)DNA诊断(基因诊断gene diagnosis)
利用分子生物学和分子遗传学的技术和原理,在DNA水平分析、鉴定遗传性疾病所涉及的基因置换、缺失、插入等突变。
基本过程:
(1)分离、扩增待测的DNA分子。
(2)用适当方法分析、鉴定DNA的异常。
可靠的DNA诊断的方法必须符合的条件:
(1)能正确扩增靶基因。
(2)能准确区分单个碱基的差别。
(3)本底和噪声低、不干扰DNA的鉴定。
(4)便于自动化操作、适合大人群普查。
(四)基因治疗(gene therapy)
向有功能缺陷的细胞补充相应的基因,以纠正或补偿其基因缺陷,从而达到治疗的目的。
1.体细胞基因治疗(somatic cell gene therapy):单独治疗受累组织,类似器官移植。
2.性细胞基因治疗(germ line cell gene therapy):仅限于动物实验。
(五)遗传病的预防
1.产前诊断
通过胎儿活检、羊膜腔穿刺、羊膜绒毛样品、母体血循环中的胎儿细胞进行基因缺陷的分析,后者更加安全,值得提倡。
2.携带者测试
基因测试可以检出阴性遗传病携带者,可以知道婚姻和计划生育。
3.症候前诊断
可以在单基因紊乱综合征发生前作出预测,指导其工作与生活。
4.遗传病易感性等方面
多基因缺陷的存在使个体易于发病,早期检测有利于疾病的预防。