第二节 药物稳定性的化学动力学基础
化学动力学是研究化学反应速度及反应机理的科学。
利用化学动力学原理可以:
(1)研究药物降解的机理;
(2)研究影响药物降解的因素及稳定化措施;
(3)预测药物制剂的有效期。
反应级数是用来阐明反应物浓度与反应速率之间关系的参数。
降解速度与浓度的关系式:
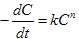
k—反应速度常数;C—反应物的浓度;n--反应级数;n=0为零级反应;n=1为一级反应;n=2 为二级反应。
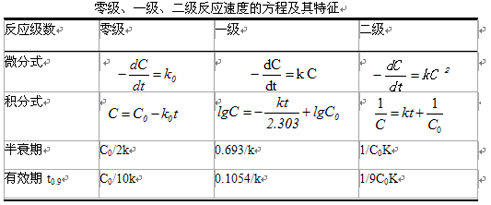
(一)零级反应
零级反应速度与反应物浓度无关,而受其他因素的影响,如反应物的溶解度,或某些光化反应中光的照度等。零级反应的速率方程为:

(二)一级反应
速率方程为:
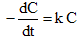
利用化学动力学原理可以:
(1)研究药物降解的机理;
(2)研究影响药物降解的因素及稳定化措施;
(3)预测药物制剂的有效期。
反应级数是用来阐明反应物浓度与反应速率之间关系的参数。
降解速度与浓度的关系式:
k—反应速度常数;C—反应物的浓度;n--反应级数;n=0为零级反应;n=1为一级反应;n=2 为二级反应。
(一)零级反应
零级反应速度与反应物浓度无关,而受其他因素的影响,如反应物的溶解度,或某些光化反应中光的照度等。零级反应的速率方程为:

(二)一级反应
速率方程为:
积分得:
![]()
通常将反应物消耗一半所需的时间为半衰期(half life),记作![]() 。
。
恒温时,一级反应的![]() 与反应物浓度无关。
与反应物浓度无关。
![]()
在制剂稳定性研究中,常用药物降低10%所需的时间(即![]() )为有效期。
)为有效期。
![]()
(三)二级反应
反应速率与两种反应物浓度的乘积成正比的反应,称为二级反应。
![]()
若其中一种反应物的浓度大大超过另一种反应物,或保持其中一种反应物浓度恒定不变的情况下,则此反应表现出一级反应的特征,故称为伪一级反应。例如酯的水解,在酸或碱的催化下,可按伪一级反应处理。