蛋白质分是由氨基酸残基组成的,它保留有末端 α - 羧基以及侧链上的各种官能团,因此具有类似氨基酸的理化性质,如两性解离和等电点等。但蛋白质是高分子化合物,又胶体和变性等性质。
![]() 一、蛋白质的两性解离和等电点
一、蛋白质的两性解离和等电点
蛋白质分子与氨基酸在似,也是一种两性电解质。在水溶液中,蛋白质中的游离氨基和羧基都可以解离,但两者的解离度不同。若向蛋白质溶液中加入适量的酸或碱,使羧基和氨基的解离度相同,此时溶液的 pH 值称为该蛋白质的等电点( pI )。在等电点时,蛋白质两性离子不向任何电极移动,其溶解度量小,容易析出沉淀。而且蛋白质的粘度、渗透压及导电能力也最小。若蛋白质溶液的 pH 值小于等电点,则蛋白质主要以阳离子存在,在电场中向负极移动;反之, pH 值大于等电点,则蛋白质主要以阴离子存在,在电场中向正极移动。若以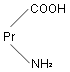 代表蛋白质,则蛋白质在水溶液中存在如下的离解平衡:
代表蛋白质,则蛋白质在水溶液中存在如下的离解平衡:
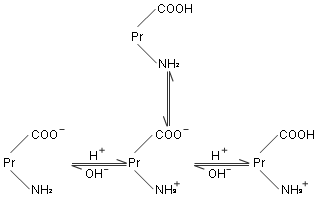
各种蛋白质有不同的等电点,见表 23-3 。人和动物体内的大多数蛋白质的等电点在 5.0 左右,而体液的 pH 值约为 7.4 ,所以体内的蛋白质大多以阴离子形式存在,可与 K+ 、 Ca+ 等离子结合成盐。
表19-3几种蛋白质的等电点
| 蛋白质名称 | 来源 | 等电点 | 蛋白质名称 | 来源 | 等电点 |
| 白明胶 乳清蛋白 酪蛋白 卵清蛋白 血清清蛋白 血清球蛋白 肌球蛋白 肌疑蛋白 |
动物皮 牛乳 牛乳 鸡蛋 马血 马血 肌肉 肌肉 |
4.8
~4.85 5.12 4.6 4.84 ~4.90 4.88 5.4 ~5.5 7.0 6.2 ~6.6 |
胰蛋白酶 胃蛋白酶 鱼精蛋白 丝蛋白 麦胶蛋白 乳球蛋白 麻仁蛋白 |
胰液 猪胃 鲑鱼精 蚕丝 小麦 牛乳 麻仁 |
5.0 2.75 12.0 ~12.4 2.0 ~2.4 6.5 4.5 ~5.5 5.5 ~6.0 |
由于各种蛋白质分子大小不同,在溶液中所带电荷的性质和数量也不同,因此它们在电场中的移动速度必然有差别,常用利这种性质来分离和测定蛋白质。这种方法称为蛋白质的电泳分析法。医学上常用电泳分析测定血清蛋白质的成分,以诊断疾病。
![]() 二、蛋白质的胶体性质
二、蛋白质的胶体性质
蛋白质分子大小已经达到胶体分散系的范围( 1nm ~ 100nm ),它们在水溶液中,暴露在分子表面的许多亲水基团(如氨基、羧基、羟基及酰胺基等)都能与水分子起水化作用,形成的水化层将蛋白质分子互相隔开。同时,蛋白质分子内可解离的极性基团,在一定的 pH 值下其表面带有相同的电荷,与其周围电荷相反的离子形成稳定的双电层。蛋白质分子在水溶液中形的水化层和双电层是蛋白质溶液作为稳定的胶体系统的主要因素,因此蛋白质溶液具有胶体的通性,如丁铎尔现象、布朗运动和不能透过半透膜等性质。
![]() 三、蛋白质的变性
三、蛋白质的变性
蛋白质分子在受到某些物理因素(如热、高压、振荡、紫外线照射及超声波等)影响,或受以某些化学因素(如酸、碱、脲、胍、重金属盐及有机溶剂等)作用时,性质常常会发生变化,如溶解度降低、生物活性丧失、某些物理化学常数的改变等。这种现象统称为蛋白质的变性,变性后的蛋白质称为变性蛋白质。
蛋白质变性的实质是蛋白质分子的空间结构的改变或破坏,即维系蛋白质分子空间结构的副键(如氢键、盐键及疏水键等)受到破坏。由此可见,蛋白质变性不影响一级结构的完整性。
蛋白质变性后,结构由紧密有序变为松散无序,部分肽链失去折叠状态或 α - 螺旋状态而展开。肽链的伸展增大了不对称程度,使蛋白质溶液的粘度增大,失去结晶性。蛋白质分子内原来包藏着的疏水基团,由于结构的松散而暴露在分表面,而原来分子表面的亲水基团则被遮掩,使水化作用减小,失去水化膜,表现为溶解度降低。某些极性基团发生改变,影响蛋白质分子的带电状态,使其容易沉淀凝固。变性作用使蛋白质分子的空间结构遭受破坏,使酶、抗体、激素等失去活性,因此在提取或制备具有生物活性的蛋白质时,要避免发生变性。
蛋白质的变性作用,随着空间结构变化程度的不同,表现为可逆变性。蛋白质变性后,其分子结构改变不大,可以恢复原有结构和性质的称为可逆变性。与之相反的,则称为不可逆变性。例如,经过短时间煮沸的胰蛋白酶,冷却后可以恢复天然胰蛋白酶的活性、结晶性等性质;用稀酸变性的血红蛋白放入弱碱溶液中,几乎可以完全恢复天然本性。
蛋白质的变性原理具有重要的实用价值,如酒精、加热、紫外线消毒灭菌和热凝法检查尿蛋白等。在制备或保存酶、疫苗、免疫血清等蛋白质制剂时,应选择合适的条件,以防止其生物活性的降低或丧失。
![]() 四、蛋白质的沉淀
四、蛋白质的沉淀
蛋白质溶液通常是比较稳定的,如果外界条件发和改变,破坏了它的稳定性,则蛋白质分子发生凝集,并从溶液中沉淀析出的现象称为蛋白质的沉淀。蛋白质溶液的稳定性与质点大小、电荷及水化作用有关。如果在蛋白质溶液中加入脱水剂除去其水化层,或改变溶液的 pH 值达到蛋白质的等点使质点失去相同的电荷,或加入电解质破坏双电层,则蛋白质分子可以凝集而沉淀,如图 19-3 所示。
对于不同蛋白质胶体溶液,所采用的破坏水化膜及带电状态使蛋白质发生凝集沉淀的方法各有差异。有些蛋白质(如白明胶)这两种稳定因素的作用都很强,只有两种因素都被消除后才会产生沉淀。另有一些蛋白质,只有一种因素起主要作用,此时只要除去这种主要的稳定因素,蛋白质就可以发生沉淀。如酪蛋白溶液,将其 pH 值调至等电点时即产生沉淀,这表明酪蛋白胶体溶液的主要稳定因素是电荷的影响。
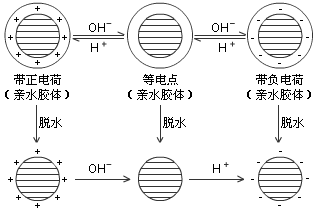
沉淀蛋白质的方法有以下几种。
(一)盐析
向蛋白质溶液中加入电解质到一定浓度时,蛋白质便沉淀析出,这种作用称为盐析。盐析所需电解质的最低浓度称为盐析浓度。
盐析作用的实质,最破坏蛋白质的溶剂化作用。当蛋白质溶液中加入盐后,一部分溶剂分子被盐离子所吸引而定向地排列在其周围。盐离子的溶剂化作用降低了蛋白质分子的溶解度,使蛋白质过饱和而沉淀析出。盐的溶剂化程度越大,则蛋白质分子去溶剂化作用就越大,盐析作用也就越强。盐析时若将溶液的 pH 值调至等电点后再加盐析剂,盐析效果会更好。
盐析蛋白质时,常用的中性盐有硫酸铵、硫酸钠和氯化钠等。硫酸铵是最常用的盐析剂,它解离的 NH+4 和 SO2-4离子都有很强的盐析能力;同时,它的溶解度大,水解度小,酸度不高。这可使等电在 4.8 ~ 6.0 范围内的天然蛋白质,在接近中性的溶液中完全沉淀析出。
不同蛋白质盐析时所需的盐析浓度不同,因此调节盐的浓度可使不同的蛋白质分段析出,达到分离蛋白质的目的,这种操作称为分段盐析。例如,在血清中加(NH4)2SO4至浓度为 2.0mol · L-1 时,则球蛋白首先沉淀析出;滤去球蛋白,再加(NH4)2SO4至浓度为3.3mol·L-1。则清蛋白沉淀析出。在临床上,利用分段盐析法是一种很有效的分离方法。
(二)有机溶剂的沉淀
在等电点时,加入极性较大的有机溶剂(如乙醇、丙酮等),可使蛋白质沉淀析出。这是利用有机溶剂对水有较大的亲合力,破坏力蛋白质分子的水化膜。有机溶剂沉淀蛋白质也是常用的方法之一,但在较高的温度或与蛋质接触时间较长时,会造成蛋白质的变性。医用消毒酒精就是利用变性的原理杀灭病菌。
(三)重金属盐的沉淀
蛋白质在 pH 值高于等电点的溶液中以阴离子的形式存在,加入重金属盐(如氯化汞、硝酸银、醋酸铅、硫酸铜等),重金属离子( Cu2+、 Hg2+ 、 Pb2+ 、 Ag+)能与蛋白质的羧基阴离子结合,生成不溶性盐的沉淀。例如:
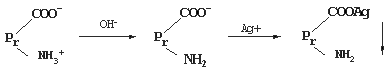
临床上,利用生蛋清和牛乳作为重金属中毒的解毒剂,就是根据这个原理。
(四)酸类的沉淀
蛋白质在 pH 值低于等电点的溶液中以阳离子的形式存在,加入某些酸类(如钨酸、苦味酸、鞣酸、磺基水杨酸、偏磷酸、三氯乙酸等),较为复杂的酸根离子与蛋白质的氨基结合,生成沉淀析出。例如:
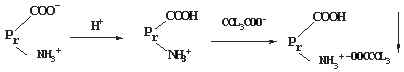
酸类的沉淀反应,可用于尿中蛋白质的检验。
![]() 五、蛋白质的颜色反应
五、蛋白质的颜色反应
蛋白质是一种结构复杂的高分子化合物,分子中存在肽链、游离的氨基和羧基以及侧链基团等结构成分,因此可以与不同的试剂产生不同的颜色反应。这些颜色反应常用于蛋白质的定性和定量分析。表 23-4 列出了几种主要的蛋白质的颜色反应。
表19-4蛋白质的颜色反应
| 反应名称
|
试剂
|
颜色
|
反应的基团
|
| 缩二脲反应 | NaOH+CuSO4 | 蓝紫、紫红 | 肽键 |
| 蛋白黄反应 | 浓 HNO3/ 氨 | 黄色、橙红 | 氨基酸中的苯基 |
| 米伦 (Millon) 反应 | 硝酸汞 / 硝酸亚汞的硝酸溶液 | 加热后显红色 | 酪氨酸的羟苯基 |
| 乙醛酸反应 | 乙醛酸 / 浓硫酸 | 紫色 | 色氨酸的吲哚基 |
| 茚三酮反应 | 茚三酮 | 蓝紫色 | 游离氨基 |