根据能够水解及水解产物的组成情况,糖类可以分为为单糖、低聚糖和多糖三类。
单糖是不能水解的多羟基醛或多羟基酮,如葡萄糖、果糖等。
低聚糖也称寡糖,是能水解生成 2 ~ 10 个单糖分子的糖类,其中以二糖最常见,如麦芽糖、蔗糖、乳糖等。 多糖是能水解生成多个单糖分子的糖类,如淀粉、糖原、纤维素等。多糖由几百、上千个单糖分子缩合而成,属于天然高分子聚合物。
单糖的种类很多,按结构中含有醛基或酮基可分为醛糖或酮糖;按所含碳原子数目,可分为丙糖、丁糖、戊糖及已糖等。最简单的单糖是甘油醛和二羟基丙酮,它们是与糖代谢有关的丙醛和丙酮糖。

自然界的单糖以戊糖和已糖最为常见,其中以葡萄糖最为重要。
![]() 一、葡萄糖的结构
一、葡萄糖的结构
(一)葡萄糖的开链结构和构型
葡萄糖的分式为 C5H12O6 ,属于已醛糖。一些性质证明它具有 2 , 3 , 4 , 5 , 6 -五羟基已醛的开链结构。 D- ( + )-葡萄糖开链结构投影式如下:

各种单糖立体异构体的构型,习惯上采用以甘没醛为标准,用 D 、 L 标记的相对构型。规定凡是单糖分子中编号最大的手性碳原子的构型与 D- 甘油醛相同者为 D- 型,与 L- 甘油醛相同者为 L- 型。天然葡萄糖 C5 上的羟基在投影式右边,与 D- 油甘醛相同,故属于 D- 型。因其具有右旋光性,所以通常称为 D- ( + )-葡萄糖,简称 D- 葡萄糖。
自然界存在的其它单糖也多为 D 型,如 D- 核糖、 D- 半乳糖、 D- 甘露糖、 D- 果糖等。
(二)葡萄糖的环状结构与变旋光现象
用开链结构可以说明葡萄糖的许多反应,但不能圆满解释另外一些实验事实。例如,晶体葡萄糖有两种:一种是从乙醇中析出的晶体,熔点为 146 ℃ ,新配制的水溶液的质量旋光本领 aM=112O · mL · g-1 · dm-1 , 称为 α -D- (+) - 葡萄糖;另一种从吡啶中析出的晶体,熔点为 150 ℃,新配制的水溶液的质量旋光本领为 aM=18.7O· mL · g-1 · dm-1,称为β-D-(+)-葡萄糖。上述两种葡萄糖水溶液的质量旋光本领自行改变最后达到定值的现象称为变旋光现象。显然,开链结构不能说明上述事实。
联系到醛可以与醇作用生成半缩醛,并经物理及化学方法证实,晶体葡萄糖是以环状结构存在。由于碳链弯曲,葡萄糖分子中的醛基与 C5上的羟基的空间位置接近,相互作用生成六元环状半醛。
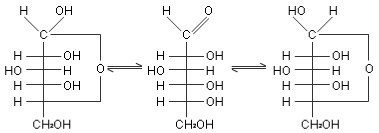
在形成环状结构的过程中,葡萄糖原有的羰基碳原子 C1成为一个新的手性碳原子,因而生成的半缩醛基就有两种构型:半缩醛羟基在投影式右边称为α型;在左边称为β型。相应的葡萄糖就有两种环状结构—α-D-(+)-葡萄糖和β-D-(+)-葡萄糖。它们在结构上的区别只是C1的构型不同,其它手性碳原子构型完全相同,所以称为端基异构体或异头物,属于非对映体。
α -D-葡萄糖和β-D-葡萄糖的晶体是稳定的,各有固定的熔点。但在水溶液中,α-D-葡萄和β-D-葡萄糖两种环状结构之间通过开链结构进行相互转化,逐渐达到动态平衡。在平衡混合物中,α-D-葡萄糖约占36%,β-D-葡萄糖约点64%,开链醛式含量很少,不足0.1%。但是,α-D-葡萄糖和β-D-葡萄糖之间的相互转化必须通过开链结构才能进行。由α-D-葡萄糖或β-D-葡萄糖晶体溶于水后,其相对含量在平衡过程中不断变化,所以溶液的质量旋光本领也随互变平衡的进程变化,最后达到定值,这就是产生变旋光现象的原因。对具有环状半缩醛结构的单糖而言,变旋光现象是它们的共性。
(三)葡萄糖环状结构,哈沃斯( Haworth)采用平面六员环透视式代替费歇尔投影式,称为哈沃斯式,5个碳原子和1个氧原子的六员环单糖看作杂环吡喃的衍生物,称为吡喃糖;把含有4个碳原子和1个氧原子的五员环单糖看作杂环吡喃的衍生物,称为呋喃糖。葡萄糖通常以吡喃糖的形式存在,分别称为α-D-(+)-吡喃葡萄糖和β-D-(+)-吡喃葡萄糖。其哈沃斯式如下:
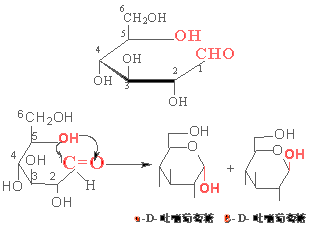
投影式左边的羟基写在环的上方,右边羟基写在环的下方,以表示其空间位置排布。当成环碳原子按顺时针方向排列时, C5上的- CH2OH 在环上方为 D 型。 D 糖中半缩醛羟基若在环下方为 α -型,在环上方为β-型
事实上,哈沃斯把环盾成平面,原子和基团垂直排布在环的上、下方,并不符合真实空间形象。与环已烷相似,吡喃糖中成环的各个原子不在同一平面上,而是以稳定的椅式构象存在。α -D-吡喃葡萄糖和β-D-吡喃葡萄糖的构象式如下:
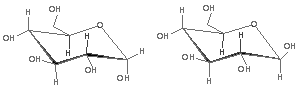
可以看出,β -D-葡萄糖中所有较大的基团都在e键上,相互距离较远,斥力较小;在α-D-吡喃葡萄糖中半缩醛羟基在α键上,其余较大基团在e键上。因此,β-型比α-型内能更低、更稳定。这也许是互变平衡混合物中β-D-葡萄糖含量最高的原因。用构象式表示单糖的环状结构。
![]() 二、果糖的结构
二、果糖的结构
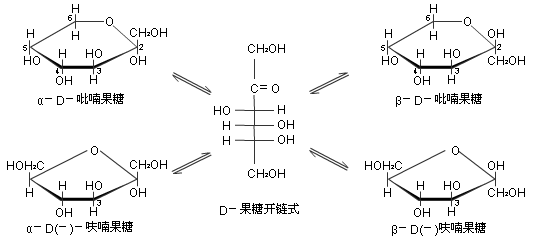
果糖分子式为 C6H12O6,属于已酮糖。其开链结构含有3个手性碳原子,由于编号最大的手性碳原子上的羟基在投影式右边,也属于D型,质量旋光本领aM=-92O· mL · g-1 · dm-1,具有左旋光性,通常称为D-(-)-果糖为无色晶体,易溶于水,有还原性和变旋光现象,广泛存在于水果及蜂蜜中,是最甜的一种糖。
游离态果糖具有吡喃糖的六员环状结构,由 C6上的羟基与酮基结合生成五员环状半缩酮,具有味喃糖结构。α-型异构和β-型异构体,在水溶液中,通过开链结构形成含有5种结构的互变平衡体系。
![]() 三、单糖的性质
三、单糖的性质
单糖通常是无色晶体,易溶于水,难溶于乙醇,不溶于醚。除二羟基丙酮外,单糖都有旋光性,质量旋光本领是鉴别各种糖的重要物理常数。
单糖是多官能团化合物,具有羰基和羟基的化学性质。由于在溶液中存在环状结构与开链式的互变平衡,所以化学反应既可按环状结构进行,也可以按开链结构进行。
(一)氧化反应
醛糖式酮糖都可以被碱性弱氧化剂氧化,如单糖与托伦试剂、斐林试剂反应,生成银镜或砖红色氧化亚铜沉淀。单糖的这种性质称为单糖的还原性。凡具有这种性质的糖称为还原糖。在临床检验中,常用班氏( Benedict )试剂作为尿糖的定性检出试剂。在碱性溶液中,得到复杂的氧化产物的混合物。
单糖 +Ag2O (托伦试剂) → 2Ag+ 复杂的氧化产物
单糖 +Cu ( OH )2(斐林试剂和班氏试剂) → Cu2O↓+复杂的氧化产物

(二)互变异构化反应
在稀碱溶液中, D-葡萄糖可以通过烯二醇中间体进行转化,得到含有D-葡萄糖、D-甘露糖和D-果糖等几种单糖的混合物。在酶的作用下,体内单糖间也可发生类似的转化。
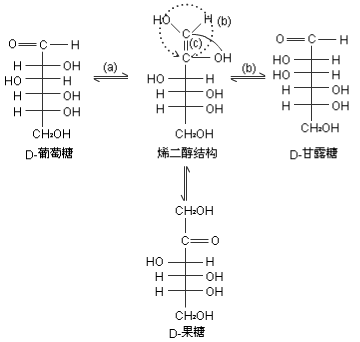
在含有多个手性碳原子的对映异构体之间,如果只有一个手性碳原子的构型不同,其余手性碳原子的构型完全相同,这样的异构体互称差向异构体。 D-葡萄糖与D-甘露糖结构上只有C2构型不同,因此它们是C2差向异构体。差向异构体之间的转化称为差向异构化。D-葡萄糖或D-甘露糖与D-果糖之间的转化,是醛糖与酮糖之间的转化,常见于体内糖代谢过程,如6-磷酸葡萄糖在异构酶作用下转变为6-磷酸果糖。