第九章 弥散性血管内凝血
概述
※弥散性血管内凝血(disseminatedor diffuse intravascular coagulation, DIC):由于某些致病因子的作用,凝血因子和血小板被激活,大量促凝物质入血,微循环中形成广泛的微血栓,消耗了大量凝血因子和血小板,继发性纤维蛋白溶解功能增强,导致出血、休克、器官功能障碍和溶血性贫血的病理过程。【重点】
血液凝固和纤溶蛋白溶解过程
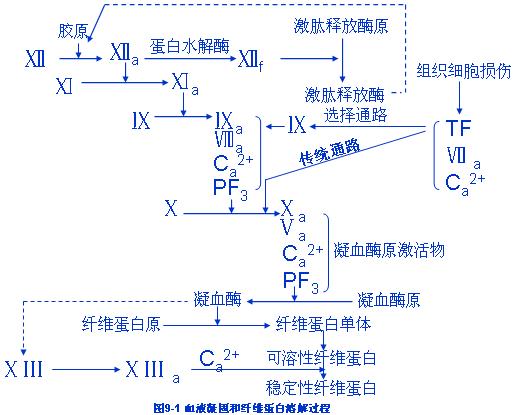
一、血液凝固过程
第一阶段:凝血酶原激活物的形成
(一)外源性凝血系统
组织因子(tissue factor,TF):分子量为47KD的跨膜糖蛋白,由263个氨基酸残基构成。作为细胞表面抗原命名为CD142。又称为组织凝血活酶或凝血因子Ⅲ。它即是凝血因子Ⅶ或活化的因子Ⅶa在细胞表面的受体,又是Ⅶ或Ⅶa的辅助因子。
一、血液凝固过程
第一阶段:凝血酶原激活物的形成
(一)外源性凝血系统
组织因子(tissue factor,TF):分子量为47KD的跨膜糖蛋白,由263个氨基酸残基构成。作为细胞表面抗原命名为CD142。又称为组织凝血活酶或凝血因子Ⅲ。它即是凝血因子Ⅶ或活化的因子Ⅶa在细胞表面的受体,又是Ⅶ或Ⅶa的辅助因子。
生理情况下,平滑肌细胞、成纤维细胞、周细胞、星形细胞、足状突细胞即血管外组织细胞, 可恒定表达TF ,以备止血。
内皮细胞、单核细胞、嗜中性粒细胞、巨嗜细胞即与血液接触细胞,正常时不表达TF,但在各种感染或炎症介质如ET IL-1、TNF等刺激下能够表达TF,引起凝血反应。
血液中的凝血因子(Ⅱ、Ⅴ、Ⅶ、Ⅷ、Ⅸ、Ⅹ、Ⅻ)都以酶原形式存在,其分子中含有带负电荷的γ-羧基谷氨酸(γ-Carboxyglutamate,GLa),由于GLa是Ca2+结合氨基酸,凝血因子Ⅶ通过Ca2+可与TF形成复合物,同时因子Ⅶ被激活为Ⅶa,成为Ⅶa-TF复合物。

此外活化的凝血因子Ⅻa ,Ⅹa, Ⅱa (凝血酶)也可使因子Ⅶ激活为Ⅶa,因而具有正反馈效应。
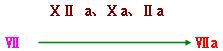
Ⅶa-TF复合物即可激活因子Ⅹ,由传统通路激活外源性凝血系统。也可激活因子Ⅸ,经选择通路激活内源性凝血系统,从而启动凝血反应。
Ⅶa-TF复合物激活了因子Ⅹ,活化的Ⅹa,Ⅴa通过Ca2+再与血小板表面带负电荷的磷酯结合,共同形成凝血酶原激活物,完成外源性凝血反应。
总之,损伤的组织,细胞释放TF入血,Ⅶa与TF形成复合物,激活因子Ⅹ,由传统通路激活外源性凝血系统,也可激活因子Ⅸ,经选择通路激活内源性凝血系统,启动凝血反应。
(二)内源性凝血系统
1、因子Ⅻ的激活
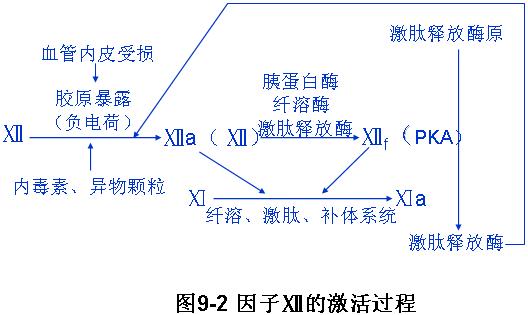
血管内皮受损,内皮下带负电荷的胶原暴露,血液中凝血因子Ⅻ与负电荷接触后,其分子构型发生改变,即被激或为Ⅻa,Ⅻa或Ⅻ在蛋白水解酶(胰蛋白酶、纤溶酶、激肽释放酶)的作用下,变成因子Ⅻ的碎片Ⅻf(PKA),使激肽释放酶原变成激肽释放酶。激肽释放酶又去进一步激活Ⅻa,使内原性凝血反应加速。Ⅻa、Ⅻf激活因子Ⅺ,使其变成活化的因子Ⅺa,还可进一补激活纤溶、激肽、补体系统。
2、因子Ⅹ的激活 Ⅺa激活因子Ⅸ使其变成活化的Ⅸa,Ⅸa,Ⅷa所含的GLa与Ca2+结合,再与血小板表面带负电荷的磷酯结合形成复合物,此复合物激因子Ⅹ,使其变成活化的Ⅹa。
3、凝血酶原激活物的形成 活化的Ⅹa.Ⅴa所含GLa通过Ca2+与血小板表面带负电荷磷酯表面结合,形成凝血酶原激活物。凝血酶原激活物的形成是内源性和外源性凝血途径中的共同环节。
第二阶段:凝血酶的形成 在凝血酶原激活物的作用下,使凝血酶原变成凝血酶。
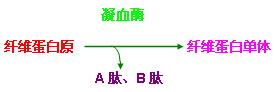
第三阶段:纤维蛋白的形成,在凝血酶的作用下,纤维蛋白裂解出A肽和B肽,变成纤维蛋白单体。
许多纤维蛋白单体通过氢键互相聚合,形成可溶性纤维蛋白多聚体。凝血酶还能激活因子ⅩⅢ,ⅩⅢa在Ca2+参与下使可溶性纤维蛋白多聚体变成不溶性的稳定的纤维蛋白多聚体,即纤维蛋白。到此血液凝固过程全部完成。
二、纤维蛋白溶解过程
《纤溶系统的组成》
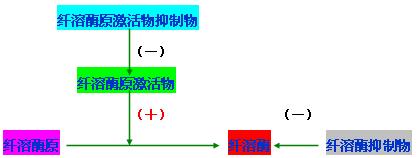
纤维蛋白溶解过程大致分两个阶段:纤溶酶原的激活和纤维蛋白(原)的溶解。
(一) 纤溶酶原的激活
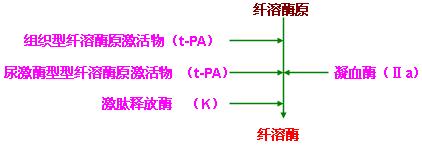
1、组织型纤溶酶原激活物(t- PA):存在很多组织中,其中以子宫,甲状腺,前列腺,肺等组织中含量较高。当组织损伤或发生变性坏死时,t-PA大量释放入血。
2、尿激酶型纤溶酶原激活物(u- PA):血管内皮细胞能产生,分泌u-PA和t-PA。激活的蛋白C(APC)可使血管内皮细胞分泌这两型激活物增加。此外,u-PA也可由肾脏产生。
3、依赖因子ⅩⅡ的激活物:激肽释放酶
纤溶酶原在纤溶酶原激活物的作用下变成纤溶酶。凝血酶同样可激活纤溶酶原变成纤溶酶。
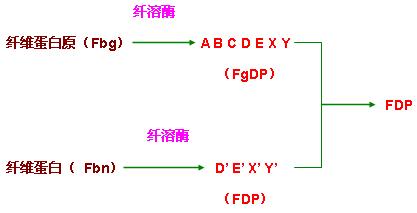
(二)纤维蛋白溶解
纤溶酶产生后,可水解纤维蛋白原(Fbg)和纤维蛋白(Fbn)
正常时凝血过程和纤溶过程保持动态平衡,使血液在心血管内自由流动。如果这一动态平衡受到破坏,凝血过程增强,纤溶过程减弱,容易发生凝血。相反,凝血过程减弱,纤溶过程增强,容易发生出血。

总之,在血液内存在四大蛋白酶系统:凝血系统、纤溶系统、激肽系统、补体系统。生理情况下保持动态平衡。在病理情况下,四大系统都可能被激活,使DIC成为一个非常复杂的病理过程。
第一节 DIC的原因和发病机制
一、 组织或细胞损伤
★《组织或细胞损伤引起DIC 的机制》【重点】
大手术、外伤、感染、产科意外(胎盘早剥,宫内死胎,羊水栓塞)、恶性肿瘤或实质性脏器坏死等情况下,损伤组织或细胞表面暴露出组织因子并释放入血,凝血因子Ⅶ通过Ca2+与组织因子形成复合物同时因子Ⅶ被激活为活化的Ⅶa。Ⅶa-TF复合物即可激活因子Ⅹ,通过传统通路启动外源性凝血系统,也可激活因子Ⅸ,通过选择通路启动内源性凝血系统,从而启动凝血反应。
二、血管内皮损伤
※《内源性凝血系统如何启动,血管内皮细胞损伤的原因及其引起DIC的机制》【重点】
内源性凝血系统的启动因子是Ⅻ因子。表面带负电荷的物质(如胶原、内毒素等)与血液中的无活性的Ⅻ因子接触后,使Ⅻ因子中精氨酸残基立体构型发生改变。作为丝氨酸蛋白酶活性部位的丝氨酸残基暴露,使其成为具有活性的Ⅻ因子(Ⅻa)。另一方面,激肽释放酶、纤溶酶、胰蛋白酶可水解Ⅻ或Ⅻa生成Ⅻf,Ⅻf作为激肽释放酶原激活物使激肽释放酶原变成激肽释放酶,后者进一步促进Ⅻ因子激活,加速内凝反应。羊水、转移的肿瘤细胞及其他异物颗粒在血液中通过表面接触,激活Ⅻ因子,可启动内源性凝血系统。
细菌、病毒、螺旋体、高热、持续的缺氧、酸中毒、抗原抗体复合物以及内毒素等,在一定的条件下,均可损伤血管内皮细胞。内皮细胞损伤,一方面,使带负电荷的胶原暴露,与血液中Ⅻ因子接触,激活Ⅻ因子,启动内源性凝血系统。另一方面,内皮细胞损伤,暴露组织因子或表达组织因子,也同时启动外源性凝血系统,导致DIC。
ⅩⅡ a和ⅩⅡf还可相继激活纤溶、激肽、补体系统,进一步促进DIC的发展。
三、血小板被激活,血细胞大量破坏
(一)血小板被激活
《膜糖蛋白的种类和功能》
血小板质膜是一种典型的双层磷酯结构,在内层与外层磷酯间散布着膜糖蛋白(glucoprotein,GP), 这些GP多数是血小板的受体。血小板的聚集和粘附是通过GP介导的。
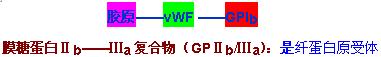
膜糖蛋白Ⅰb(GPⅠb):是血管性假血友病因子(vWF)的受体,参与血小板与内皮下胶原的粘附。vWF在巨噬细胞,血管内皮细胞的产生,它可能是血小板表面受体糖蛋白与内皮下胶原的桥梁。vWF通过一特异部位与胶原结合,再与作为受体GPIb结合,介导血小板与内皮下胶原粘附。
★《血小板被激活引起DIC的机制》【难点】
1、粘附:当外伤等原因导致血管内皮细胞损伤,暴露出胶原后,血小板膜糖蛋白GPIb通过血管性假血友病因子(vWF)与胶原结合,产生粘附作用。
2、激活:胶原、凝血酶、ADP、肾上腺素、TXA2、PAF等均可作为激活剂分别与血小扳表面的相应受体结合,血小板被激活。
3、释放:血小板被激活后引起释放反应,其中致密颗粒释放ADP、5-HT、纤维蛋白原,凝血酶敏感蛋白,纤维连接蛋白等粘附蛋白,进一步激活血小板。另一方面甘油二酯(DG)使蛋白激酶C激活,进一步使蛋白磷酸化,调节血小板的功能。此外,磷酯酶A2被激活,使血小板膜磷脂裂解产生花生四烯酸,进一步产生TXA2。TXA2有很强的促进血小板聚集作用。
4、搭桥:激活剂与血小板膜相应受体结合后,使血小板膜糖蛋白GPⅡb/Ⅲa复合物激活。活化的GPⅡb/Ⅲa是血小板膜上的纤维蛋白原受体,纤维蛋白原为二聚体可与两个相邻的血小板膜GPⅡb/Ⅲa相结合,产生“搭桥”作用,使血小板聚集。
5、形成血栓:活化血小板表面出现磷脂酰丝氨酸或肌醇磷脂等带负电荷磷脂,凝血因子Ⅶ、Ⅸ、X、凝血酶原等所含γ-羧基谷氨酸(GIa)与Ca2+结合,再与血小板表面带负电荷的磷酯结合,使这些凝血因子在血小板磷脂表面被浓缩、局限,从而产生大量凝血酶。进而形成纤维蛋白网,网络其它血细胞,形成血栓。
(二) 血细胞破坏
★《血细胞破坏引起DIC的机制》【重点】
①血液中的单核细胞、中性粒细胞等,在内毒素、IL-1、TNF等的刺激下均可以诱导表达TF,从而启动凝血反应。此外,急性早幼粒细胞性白血病患者,在化疗、放疗等导致白血病细胞大量破坏时,释放组织因子样物质,也可促进DIC的发生。
②血液中的红细胞大量破坏,特别是伴有较强免疫反应的急性溶血时,由于释放大量ADP,ADP作为血小板激活剂,促进血小板粘附、聚集等,导致凝血。红细胞膜磷脂则可浓缩,局限Ⅶ、Ⅸ、Ⅹ及凝血酶原等凝血因子,导致大量凝血酶生成,促进DIC的发病。
四、促凝物质入血
1、急性坏死性胰腺炎时,大量胰蛋白酶入血,可激活凝血酶原,促进凝血酶生成。

2、蛇毒,如斑蝰蛇毒含有的两种促凝成分或在Ca2+参与下激活因子Ⅹ或加强因子Ⅴ的活性,促进DIC的发生。而锯鳞蝰蛇毒则可直接使凝血酶原变为凝血酶。
第二节 影响DIC发生发展的因素
一、单核吞噬细胞系统功能受损
单核吞噬细胞系统(mononuclear phagocyte system,MPS)具有吞噬、清除血液中的凝血酶, 纤维蛋白原及其他促凝物质,也可清除纤溶酶、FDP及内毒素等。
全身性施瓦茨蔓反应
(generalized shwartzman reaction,GSR)
rabbit
第一次 iV 间隔24h 第二次 iV
ET ET 发生DIC
二、血液凝固的调控失调
★《血管内壁主要存在两种抗凝机制,每种抗凝机制中的抗凝物质的组成成分及其作用是什么,与DIC的发生发展有何关系》【难点】
血管内壁主要存在两种抗凝机制:①以蛋白C为主体的蛋白酶类凝血抑制机制。②以抗凝血酶—Ⅲ(AT-Ⅲ)为首的蛋白酶抑制物类抑制机制。
1、蛋白酶类抗凝物质
⑴蛋白C(PC):蛋白C是在肝脏合成后分泌入血,以酶原形式存在于血液中的蛋白酶类物质。由凝血酶把它激活,激活的蛋白C(APC)可水解凝血因子Ⅴa、Ⅷa使其灭活而达到抗凝作用。
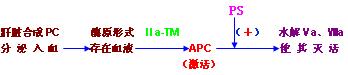
⑵蛋白S(PS):是血管内皮细胞或血小板膜上一种含γ-羧基谷氨酸的蛋白质。蛋白S 作为细胞膜上APC受体或者与APC协同,促进APC清除Ⅴa、Ⅷa使其灭活。PC是作为APC的辅酶而起作用。
⑶血栓调节蛋白(TM):是内皮细胞膜上凝血酶受体之一,与凝血酶结合,形成Ⅱa-TM复合物后,降低凝血酶活性,却大大加强了凝血酶激活蛋白C的作用。因此,TM是是使凝血酶由促凝转向抗凝的重要的血管内凝血抑制成份。
2、蛋白酶抑制物类抗凝物质
⑴抗凝血酶-Ⅲ(AT-Ⅲ):是丝氨酸蛋白酶抑制物,由于许多凝血因子(Ⅱa、Ⅶ、Ⅸa、Ⅹa、Ⅻa等)均属丝氨酸蛋白酶,因此,AT-Ⅲ具有明显抗凝作用。
⑵组织因子途径抑制物(TFPI):属于蛋白酶抑制物类抗凝物质,其主要作用抑制Ⅶa、Ⅹa凝血因子。
如果上述蛋白酶类抗凝物质及蛋白酶抑制物类抗凝物质缺乏或活性下降,使血液凝固与抗凝机制失调,则容易引起DIC。
三、肝功能严重障碍
多数凝血因子在肝脏合成,主要的抗凝物质如蛋白C、AT-Ⅲ等以及纤溶酶原均在肝脏合成。激活的凝血因子也在肝脏灭活。当肝功能严重障碍时,可使凝血、抗凝、纤溶过程失调。此外,当肝细胞大量坏死时,也可释放组织因子等。这些因素在DIC的发生发展中均有一定的作用。
四、血液高凝状态
◆《使血液处于高凝状态的因素及其引起DIC的机制》【重点】
1、妊娠期 妊娠三周开始孕妇血液中血小板及凝血因子(Ⅰ、Ⅱ、Ⅴ、Ⅸ、Ⅻ等)逐渐增多;而AT-Ⅲ、t-PA、u-PA降低;胎盘产生的纤溶酶原激活物抑制物(PAI)增多,血液渐趋高凝状态,妊娠末期最明显,故当产科意外(胎盘早期剥离、宫内死胎、羊水栓塞等)时,易发生DIC。
2、酸中毒 酸中毒可损伤血管内皮细胞,启动内源性和外源性凝血系统,引起DIC的发生。此外,酸中毒时血液PH值降低,使凝血因子的酶活性升高,肝素的抗凝活性减弱,血小板聚集性加强等,使血液处于高凝状态,易引起DIC。
3、抗磷酯抗体(antiphospholipid antibody,APA),
APA是目前所知道的直接诱发血液高凝状态的唯一自身抗体。 APA可能作用于凝血过程的几个环节:APA可损伤血小板和内皮细胞膜,使带负电荷的磷脂暴露出胞膜表面,从而促进凝血酶原激活物的形成,导致凝血;抑制蛋白C的活性或抑制活化蛋白C的活性以及使蛋白S减少等作用,这些均使血液处于高凝状态,诱发血栓形成。
五、微循环障碍
此外不恰当地应用纤溶抑制剂-6-氨基已酸。
第三节 DIC的分期和分型
一、分期
1、高凝期:
2、消耗性低凝期:
3、继发性纤溶亢进期:
二、分型
(一)按DIC发生速度分型
1、急性型:
2、亚急性型:
3、慢性型
(二)按DIC的代偿情况分型
根据凝血因子和血小板的消耗和代偿性生成的情况可将DIC分为三型:

局部型DIC:局限某一脏器的多发性微血栓症。
第四节 DIC的功能代谢变化及临床表现
一、出血
★《DIC引起出血的机制》【重点】
(一)凝血物质被消耗而减少 在DIC发生发展过程中,消耗了大量凝血因子和血小板,肝和骨髓代偿性生成不足,则使凝血因子和血小板明显减少。
(二)纤溶系统激活
1、血液中因子Ⅻ激活为Ⅻa的同时,激肽系统也被激活,产生激肽释放酶,激肽释放酶使纤溶酶原变成纤溶酶。
2、有些富含纤溶酶原激活物的器官,如子宫、前列腺、肺等,当其微血管内形成大量微血栓,导致缺血、缺氧,变性坏死时,可释放大量t-PA,激活纤溶系统。
3、应激时,SAMS兴奋,肾上腺素等引起血管内皮细胞合成释放纤溶酶原激活物增多。
4、缺氧等原因使血管内皮细胞损伤,释放纤溶酶原激活物(t-PA,u-PA)增多,从而激活纤溶系统,生成大量纤溶酶。
纤溶酶除可使纤维蛋白(原)降解外,还能水解凝血因子Ⅴ、Ⅷ、Ⅱa、Ⅻa等,使之进一减少。
(三)FDP的形成
纤维蛋白(原)在纤溶酶的作用下产生FDP,可通过强烈地抗凝作用而引起出血。
二、休 克
急性DIC常伴发休克。★《急性DIC伴发休克的机制》
1、由于微血管内大量微血栓形成,使回心血量明显减少。
2、广泛出血使血容量减少。
3、心肌损伤,使心输出量减少。
4、在DIC形成过程中,凝血因子Ⅻ的激活,可相继激活纤溶,激肽和补体系统,产生一些血管活性物质:
① C3a、C5a可使嗜碱性粒细胞和肥大细胞释放组胺。
②激肽、组胺可使微血管平滑肌舒张,通透性增高,使外周阻力降低,回心血量减少。
③ FDP的某些成分(A、B、C片段)有增强组胺、激肽的作用,促进微血管舒张。这些均可使全身微循环障碍,促进休克的发生、发展。
急性DIC常伴发休克,重度晚期休克又可促进DIC的发展,两者互为因果,形成恶性循环。
三、器官功能障碍
微血栓形成阻塞局部的微循环,造成缺血,局灶性坏死,严重或持续时间较长可导致受累脏器功能衰竭。
1、肾:双侧肾皮质坏死及急性肾功能衰竭。
2、肺:呼吸困难,肺出血,呼吸衰竭。
3、肝:黄疸,肝功能衰竭
4、消化系统:呕吐、腹泻,消化道出血。
5、肾上腺:肾上腺皮质出血、坏死,急性肾上腺皮质功能衰竭,表现血压下降,休克等,称华-佛综合症(Waterhouse-Frderichsen syndrome)。
6、垂体:坏死,性腺功能减退,闭经,生殖器官萎缩等,称席汉综合症(Sheehan syndrome).
7、神经系统:由于微血管阻塞,蛛网膜下腔,脑皮质,脑干等出血,可出现神志模糊,嗜睡,昏迷,惊厥等症状。
四、贫血
◆微血管病性溶血性贫血(microangiopathic hemolytic anemia,MHA )【重点】:这种贫血除具有溶血性贫血的一般特征外,外周血涂片中可见一些特殊形态的红细胞及其碎片,统称为裂体细胞或红细胞碎片,这些碎片由于脆性高,易发生溶血。
◆ DIC时产生红细胞碎片的主要机制(DIC时发生微血管病性溶血性贫血的机制)【重点】
①当微血管中有纤维蛋白性微血栓形成时,纤维蛋白丝在微血管腔内形成细网,当循环中的红细胞流过由纤维蛋白丝构成的网孔时,常会粘着,滞留或挂在纤维蛋白丝上。此时由于血流的不断冲击,可引起红细胞破裂。
②在微血流通道发生障碍时,红细胞还可能通过肺组织等的微血管内皮细胞间的裂隙,被“挤压”到血管外组织中去。这种机械性损伤也同样造成红细胞扭曲,变形和碎裂。
③除机械作用外,某些DIC的病因也有可能使红细胞变形性降低,使其容易破碎。
